
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温时,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。按要求回答下列问题:
(1)H2S在水中的二级电离常数表达式Ka2=______;0.1mol/LNa2S溶液中离子浓度由大到小的顺序为__________.
(2)常温下,向0.1mol/LH2S溶液中通入HCl或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。

①当溶液中c(S2-)=1.4×10-19mol/L时,溶液中c(OH-)=______,水电离产生的c(H+)=______.
②当pH=13时,溶液中的c(H2S)+c(HS-)=_______.
(3)在工业废水处理中常用H2S将Mn2+转化为MnS除去。常温下,向含有0.010mol·L-1 Mn2+废水中通入H2S以调节废水的pH,当c(HS-)=2.0×10-4mol·L-1时,Mn2+开始沉淀,此时废水的pH=___。[已知Ksp(MnS)=1.4×10-15]
【答案】 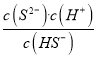 c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) 1.0×10-13 mol·L-1 1.0×10-13 mol·L-1 0.043 mol·L-1 5(或5.0)
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) 1.0×10-13 mol·L-1 1.0×10-13 mol·L-1 0.043 mol·L-1 5(或5.0)
【解析】(1)H2S在水中的电离方程式为:H2S![]() HS-+H+、HS-
HS-+H+、HS-![]() S2-+H+,所以二级电离常数表达式Ka2=
S2-+H+,所以二级电离常数表达式Ka2=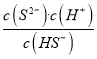 ;0.1mol/LNa2S溶液中硫离子水解,溶液显碱性,离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);(2)①根据图像可知当溶液中c(S2-)=1.4×10-19mol/L时pH=1,则溶液中c(OH-)=1×10-13 mol·L-1,水电离产生的c(H+)等于溶液中氢氧根的浓度,为1.0×10-13 mol·L-1;②当pH=13时溶液中c(S2-)=5.7×10-2mol/L,根据硫原子守恒溶液中的c(H2S)+c(HS-)=0.1mol/L-0.057mol/L=0.043mol/L;(3)Mn2+开始沉淀时溶液中c(S2-)=
;0.1mol/LNa2S溶液中硫离子水解,溶液显碱性,离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);(2)①根据图像可知当溶液中c(S2-)=1.4×10-19mol/L时pH=1,则溶液中c(OH-)=1×10-13 mol·L-1,水电离产生的c(H+)等于溶液中氢氧根的浓度,为1.0×10-13 mol·L-1;②当pH=13时溶液中c(S2-)=5.7×10-2mol/L,根据硫原子守恒溶液中的c(H2S)+c(HS-)=0.1mol/L-0.057mol/L=0.043mol/L;(3)Mn2+开始沉淀时溶液中c(S2-)= ![]() ,根据H2S的二级电离常数可知溶液中氢离子浓度是
,根据H2S的二级电离常数可知溶液中氢离子浓度是![]() ,所以pH=5。
,所以pH=5。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】表是A、B、C、D五中有机物质的相关信息:
A | B | C | D | E |
①能使溴的四氯化碳溶液褪色; | ①由C、H两种元素组成; | ①由C、H、O三种元素组成; | ①相对分子质量比C少2; | ①由C、H、O三种元素组成; |
(1)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2 . 当n=时,这类有机物开始出现同分异构体.
(2)A与溴的四氯化碳溶液反应的生成物的结构简式;该生成物在一定条件下可用于制取最简单的二元醇方程式为: .
(3)B具有的性质是(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在催化剂作用下,B与溴反应的化学方程式: .
(4)C与E反应能生成酯,该反应类型为;其化学反应方程式为: .
(5)D在一定条件下能发生银镜反应,其化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答:
(1)近年来,我国高铁迅猛发展,为人们的出行带来便利.人们利用如下反应焊接铁轨: 8Al+3Fe3O4 ![]() 4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
(2)钠元素有NaCl、Na2O2、NaHCO3、Na2SiO3等多种重要的化合物.请根据题意选择钠的化合物的化学式填空:其中常用来作为潜水艇和呼吸面具中氧气来源的淡黄色固体是 , 常用来烘制糕点,也可用作抗酸药的是 .
(3)向FeCl2溶液中通入Cl2 , 反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣ . 向所得溶液中滴加KSCN溶液,溶液变成色,我们可以利用这一现象检验Fe3+的存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在酸性溶液中能大量共存的无色溶液( )
A.Na+、Cl-、NO3-、SO42-B.K+、Cu2+、NO3-、Cl-
C.Mg2+、Cl-、SO42-、HCO3-D.Ba2+、NO3-、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳元素的叙述,不正确的是( )
A. 在细胞中,碳元素属于大量元素
B. 碳元素是构成细胞的最基本的元素
C. 碳元素参与生物体内所有化合物的组成
D. 地球上的生命是在碳元素的基础上建立起来的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某酸(HA) 溶液中逐滴加入0.1mol/L的氨水,所得溶液的pH及导电能力与加入氨水的体积关系如图所示。下列说法中不正确的是

A. HA为弱酸
B. b点对应溶液pH=7,此时HA溶液与氨水恰好完全反应
C. c点对应的溶液存在c(OH-)=c(H+)+c(HA)
D. a、b、c三点中,b点对应的溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)时放出72kJ的热量,有关物质的相关数据如下表:
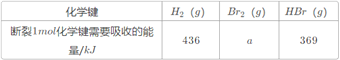
则表中a为( )
A. 404 B. 260 C. 230 D. 200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(1)请写出金属钒与浓硝酸反应的离子方程式:__________________________________,
(2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:___________。
(3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:______________________________________。
(4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:______、______。
(5)工业上用接触法制硫酸时要用到V2O5。在氧化SO2的过程中,450℃时发生V2O5与VO2之间的转化:V2O5+SO2=2VO2+SO3、4VO2+O2=2V2O5,说明V2O5在接触法制硫酸过程中所起的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
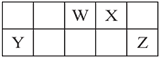
A. 氢化物沸点:W>Z B. 氧化物对应水化物的酸性:Y>W
C. WX2是酸性氧化物 D. 简单离子的半径: Y>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com