
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:
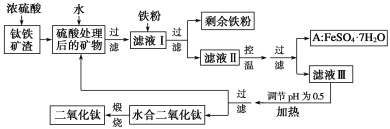
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
【答案】TiO2+2H2SO4===Ti(SO4)2+2H2O或TiO2+H2SO4===TiOSO4+H2O 2Fe3++Fe===3Fe2+Fe+2H+===H2↑+Fe2+Ti++ 4H2O![]() TiO2·H2O+4H+加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解H2O、FeSO4、H2SO41.60a+3.20b+1.60c
TiO2·H2O+4H+加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解H2O、FeSO4、H2SO41.60a+3.20b+1.60c
【解析】
(1)化学方程式为:TiO2+2H2SO4=Ti (SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O;
(2)浓硫酸有强氧化性,加入钛铁矿渣中能生成Fe3+,加入铁粉,发生Fe+2Fe3+=3Fe2+;铁粉还可以与溶液中过量的H+反应,离子方程式为:Fe+2H+=Fe2++H2↑;
(3) 钛盐水解的离子方程式:Ti++ 4H2O![]() TiO2
TiO2![]() H2O+4H+;
H2O+4H+;
(4)影响钛盐水解的因素有浓度、温度等,高温水蒸气使水解平衡移动的作用是:加水、加热、降低H+浓度均可促进钛盐水解;
(5)根据该工艺流程知:滤液Ⅲ的主要成分为大量的钛盐、溶解的硫酸亚铁、少量的硫酸(混合液pH达0.5)等,钛盐水解后过滤去水合二氧化钛,得到的滤液中含有未水解的钛盐及FeSO4、H2SO4、H2O等;
(6)依题意A与适量氢氧化钠溶液恰好完全反应,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,根据开始加入A为2a×103mol,可知加入氢氧化钠为4a×103mol;后来又加入12b×103mol的A和
20cmol的铁,由Na2SO4、FeSO4、Fe2(SO4)3、Fe2O3等化学式的定量组成和守恒思想分别可求得以下各量:利用Na+离子守恒,n(NaOH)=2n(Na2SO4),可知Na2SO4物质的量为20amol;利用SO42-离子守恒,n(FeSO4)=n(Na2SO4)+3n[Fe2(SO4)3],可知Fe2(SO4)3物质的量为(20a+120b-20a)mol×![]() =40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2)mol×
=40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2)mol×![]() =(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg
=(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:

(1)写出工业上制取Cl2的化学方程式_____________________________________。
(2)在“反应液I”中加入KOH固体的目的是①_________________,②提供碱性环境。
(3)写出Fe(NO3)3溶液与碱性KClO溶液反应的化学方程式:______________________。
(4)K2FeO4可作为新型多功能水处理剂的原因是:
①_____________________,②_________________________。
(5)从“反应液II”中分离出K2FeO4后,副产品是_________________(写化学式)。
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下2 mL 1 mol·L-1 NaHCO3溶液,pH约为8,向其中滴加几滴饱和CaCl2溶液,有白色沉淀和无色气体生成。下列说法中,不正确的是
A. NaHCO3溶液中,HCO3-水解程度大于其电离程度
B. NaHCO3溶液中,c(Na+) > c(HCO3-) > c(OH-) > c(H+)
C. 最终所得的混合溶液中,c(Na+) + c(H+) = c(HCO3-) + 2c(CO32-)+ c(OH-)
D. 滴加饱和CaCl2溶液促进了HCO3-的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HA 为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如图所示。向10 mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列说法中,不正确的是

A. pH=9时,c(A-)=c(HA)
B. x=0时,1
C. HA的电离平衡常数ka=10-5
D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是
A. 确定化学式→确定实验式→确定结构式→分离、提纯
B. 分离、提纯→确定化学式→确定实验式→确定结构式
C. 分离、提纯→确定结构式→确定实验式→确定化学式
D. 分离、提纯→确定实验式→确定分子式→确定结构式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法正确的是
A. 涤纶、有机玻璃、光导纤维都是有机高分子化合物
B. 大豆中含有丰富的蛋白质,豆浆煮沸后蛋白质变为了氨基酸
C. 棉花和合成纤维的主要成分均为纤维素
D. 常用于制备染料、医药、农药等的酚类物质可来源于煤的干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学现象和化学概念表述正确的是
A. 0.5molFe和含1 mol HNO3的稀溶液充分反应后,滴入KSCN溶液,溶液变红
B. Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
C. 含有143个中子的U(92号)原子的原子符号: ![]() U
U
D. 1mol H3PO3最多可与2 mol NaOH发生中和反应,因此Na2HPO3属于正盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生反应2A+B=2C+D,若最初A、B都是8mol,在前10s 内A 的平均速率为0.24mol(Ls)-1,则10s时B的物质的量是
A.2.4molB.3.2molC.4.8molD.5.6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com