
| A. | 胆矾的形状改变,质量不变 | B. | 体系中不再发生溶解过程 | ||
| C. | 溶液质量减小,浓度不变 | D. | 溶液中溶剂质量增大 |
科目:高中化学 来源: 题型:填空题
 (1)下列事实不能说明醋酸是弱酸的是①③
(1)下列事实不能说明醋酸是弱酸的是①③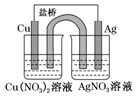 (3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.
(3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 钠和冷水反应:Na+2H2O=Na++OH-+H2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 氢氧化钡溶液与稀硫酸反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )
某化合物的试剂瓶上有如图标志:下列物质的包装上应分别贴上上述标签是( )| A. | 浓HNO3、P4(白磷) | B. | 乙醇、汞液 | ||
| C. | 氯水、KClO3 | D. | 双氧水、“84”消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
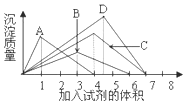
| A. | 往AlCl3溶液中逐滴加入NaOH溶液 | B. | 往澄清石灰水中逐渐通入CO2气体 | ||
| C. | 往FeCl3溶液中逐滴加入NaOH溶液 | D. | 往NaAlO2溶液中滴加入盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2CO3 | |
| D. | (NH4)2SO4 NH4Cl NaNO3 Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 符合条件 | 对应物质 |
| 混合物 | |
| 电解质,但熔融状态下不导电 | |
| 电解质,但难溶于水 | |
| 单质,本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
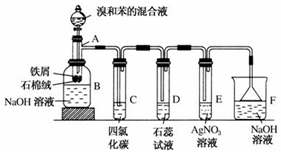 苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.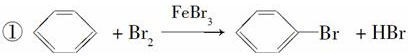 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com