
【题目】将可逆反应:2NO2![]() 2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ②⑤⑥
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是(填字母序号, 下同)__________。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250 °C | 300 °C | 350 °C |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH__________0(填”>”“< “或”=“);
②某温度下,将2 mol CO和6 mol H2充入2 L 的密闭容器中,充分反应后,达到平衡时测得c(CO)=
0.2 mol L1,则CO的转化率为_______,此时的温度为______________。
(3)要提高CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(4)300 °C,一定的压强下,5mol CO与足量H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡时数据 | CH3OH的浓度 / (mol L1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强/ Pa | p1 | p2 | p3 | |
反应物的转化率 | α1 | α2 | α3 | |
下列说法正确的是_________。
A.2 c1>c3 B.a+b<90.8
C.2p2 <p3 D.α1 +α3<l
(5)为了寻找合成甲醇的温度和压强的适宜条件, 某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
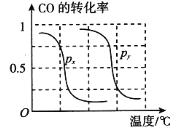
①则上表中剩余的验条件数据a=_________,b=_________。
②根据反应的特点,上图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=_________MPa。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素形成的化合物有着广泛的用途。 请回答下列问题:
(1) 过二硫酸及其盐在工业上常用作强氧化剂。
①过二硫酸的结构为 ,其中氧元素的化合价为________。
,其中氧元素的化合价为________。
②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色。该反应的离子方程式为______。
③电解法是制备过二硫酸钾的方法之一, 其装置示意图如下:

则:b 为电源的______极; 阳极反应式为_________________; 导线中流过 1 mol 电子时, 理论上通过阳离子交换膜的K+的数目为___________。
(2)Na2SO4是重要的工业原料,检验其溶液中含有SO42-的操作及现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应: 3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O,现将铜片加入到500mL稀HNO3中,反应一段时间后生成标况下NO气体4.48L,求:
(1) 生成4.48LNO气体转移的电子数目.
(2) 被还原的稀HNO3的物质的量.
(3) 参加反应的稀HNO3和反应产生的CuNO3)2的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是一个将微观粒子与宏观物质联系起来的物理量。下列说法正确的是( )
A.1mol H2的体积为22.4 L
B.1mol SiO2含有6.02×1023个分子
C.1mol O2的质量为32g
D.0.1mol/L MgCl2溶液含0.1mol Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )。
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2的反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及现象能够达到对应实验目的的是
选项 | 实验操作及现象 | 实验目的 |
A | 将SO2通入到Ba(NO3)2溶液中,产生白色沉淀 | 证明SO2与可溶性钡盐溶液反应产生沉淀 |
B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下,Ksp(BaCO3)>Ksp(BaSO4) |
C | 常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中说明乙醇作为燃料的优点的是
①燃烧时只发生氧化反应 ②充分燃烧的产物不污染环境③乙醇是一种再生能源 ④燃烧时放出大量的热
A. ②③ B. ②④ C. ①③④ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com