
����Ŀ����������Ϊԭ�ϣ�ͨ��̼�Ȼ�ԭ���ɺϳɵ�������AlN����ͨ����ⷨ����ȡ���������ʱ����������CO2��ͨ��������̼���黯�����ã�
��ش�
��1����֪��2Al2O3��s���T4Al��g��+3O2��g����H1=3351KJmol��1
2C��s��+O2��g���T2CO��g����H2=��221KJmol��1
2Al��g��+N2��g���T2AlN��s����H3=��318KJmol��1
̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��___________________________��
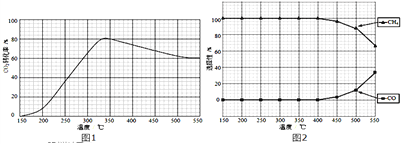
��2���ڳ�ѹ��Ru/TiO2���£�CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ�����CO2ת���ʡ�CH4��COѡ�������¶ȱ仯����ֱ���ͼ1��ͼ2��ʾ��ѡ���ԣ�ת����CO2������CH4��CO�İٷֱȣ���
��Ӧ��CO2��g��+4H2��g��![]() CH4��g��+2H2O��g����H4
CH4��g��+2H2O��g����H4
��Ӧ��CO2��g��+H2��g��![]() CO��g��+H2O��g����H5
CO��g��+H2O��g����H5
������˵������ȷ����_______
A����H4����
B���¶ȿ�Ӱ������ѡ����
C��CO2ƽ��ת�������¶���������������
D�������������䣬��CO2��H2�ij�ʼ����ȸı�Ϊ1��3�������CO2ƽ��ת����
��350��ʱ����Ӧ����t1ʱ�̴ﵽƽ�⣬ƽ��ʱ�������ΪVL���¶��·�Ӧ���ƽ�ⳣ��Ϊ______����a��V��ʾ��
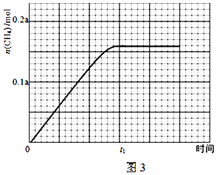
��350����CH4���ʵ�����ʱ��ı仯������ͼ3��ʾ������400����0��t1ʱ��CH4���ʵ�����ʱ��ı仯����_______��
��3�������ױ�����CO2�����ڼ���ˮ��Һ�е�����ɼ��飬���ɼ���ĵ缫��Ӧʽ��_______��
���𰸡� 3C��s��+Al2O3��s��+N2��g��=2AlN��s��+3CO��g����H=+1026KJ/mol/L CD ![]()
 CO2+6H2O+8e���TCH4+8OH��
CO2+6H2O+8e���TCH4+8OH��
��������(1)��֪����2Al2O3(s)===4Al(g)��3O2(g)����H1��3 351 kJ��mol��1����2C(s)��O2(g)===2CO(g)����H2����221 kJ��mol��1����2Al(g)��N2(g)===2AlN(s)����H3����318 kJ��mol��1�����ݸ�˹���ɢ١�![]() ���ڡ�
���ڡ�![]() ���ۼ��õ�̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��3C(s)��Al2O3(s)��N2(g)===2AlN(s)��3CO(g)����H����H1��
���ۼ��õ�̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��3C(s)��Al2O3(s)��N2(g)===2AlN(s)��3CO(g)����H����H1��![]() ����H2��
����H2��![]() ����H3=+1026 kJ��mol��1��
����H3=+1026 kJ��mol��1��
��2����A��ͼ1�У�������̼ת�����������Ƿ�Ӧ������У���һ���¶ȴﵽƽ��״̬������ƽ�������ƶ���������̼��ת���ʳ��¶����߶���С��˵������ӦΪ���ȷ�Ӧ����H4��0��ѡ��A��ȷ��B��ͼ2������֪��ͼ�����߱仯�������¶����ߵ�400�����ϣ�CH4��COѡ�������¶�Ӱ�죬������٣�һ����̼���࣬�¶ȿ�Ӱ������ѡ���ԣ�ѡ��B��ȷ��C��������̼ת�����������Ƿ�Ӧ�������δ�ﵽƽ��״̬���ﵽƽ��״̬�����¶����߶�����̼ת���ʼ�С��ѡ��C����D��CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ����CO2��H2�ij�ʼ����ȸı�Ϊ1��3��������̼��ת���ʼ�С��ѡ��D����ѡCD�����ڳ�ѹ��Ru/TiO2���£�CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ��350��ʱ����Ӧ����t1ʱ�̴ﵽƽ�⣬ƽ��ʱ�������ΪVL��������̼��ת����Ϊ80%�� CO2��g��+4H2��g��![]() CH4��g��+2H2O��g��
CH4��g��+2H2O��g��
��ʼ��(mol) 0.2a 0.8a 0 0
�仯��(mol) 0.16a 0.64a 0.16a 0.32a
ƽ����(mol) 0.04a 0.16a 0.16a 0.32a
��Ӧ���ƽ�ⳣ��K=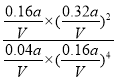 =
=![]() ���۷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���������̼��ת���ʼ�С����ͼ������֪���ӽ�72.5%����������ʵ�����С��С��350��ʱ��������ʵ������ﵽƽ������Ҫʱ������
���۷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���������̼��ת���ʼ�С����ͼ������֪���ӽ�72.5%����������ʵ�����С��С��350��ʱ��������ʵ������ﵽƽ������Ҫʱ������
CO2��g��+4H2��g��![]() CH4��g��+2H2O��g��
CH4��g��+2H2O��g��
��ʼ��(mol) 0.2a 0.8a 0 0
�仯��(mol) 0.145a 0.58a 0.145a 0.29a
ƽ����(mol) 0.055a 0.22a 0.145a 0.29a
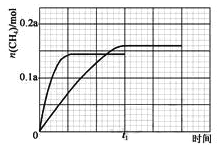
����ͼ�ﵽƽ��״̬����0.145amol�������¶ȼӿ췴Ӧ���ʣ��ﵽƽ������Ҫʱ�����̣��õ�ͼ��Ϊ�� ����3��CO2�����ڼ���ˮ��Һ�е�����ɼ��飬��ϵ���غ��ԭ���غ���ƽ���У����ɼ���ĵ缫��ӦʽΪ��CO2+6H2O+8e���TCH4+8OH����
����3��CO2�����ڼ���ˮ��Һ�е�����ɼ��飬��ϵ���غ��ԭ���غ���ƽ���У����ɼ���ĵ缫��ӦʽΪ��CO2+6H2O+8e���TCH4+8OH����


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1��2�������鳣����Ϊ��ɫҺ�壬�е�83.5�棬�ܶ�1.23g/mL��������ˮ�������ڴ����ѡ���ͪ���л��ܼ����Ҵ��ķе�Ϊ78.5�森ij��ѧ����С��Ϊ̽��1��2�����������ȥ��Ӧ�����������ʵ��װ�ã���ش��������⣮ 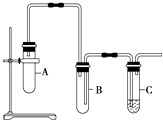
��1����ش���μ��װ��������
��2����װ��A�д��Թ����ȼ���1��2���������NaOH���Ҵ���Һ���ټ������Ƭ��Ŀ���� �� ����װ��C���Թ����������ϡ��ˮ��
��3��Ϊ��ʹ��Ӧ��75�����ҽ��У����õķ����� ��
��4����װ��A�д��Թ������ӵij������ܵ������� �� װ��B�������� ��
��5��֤��1��2���������ѷ�����ȥ��Ӧ�������� �� װ��A��C�з�����Ӧ�Ļ�ѧ����ʽΪװ��A�� װ��C ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaHCO3��Na2CO3��10H2O�����6.56g����ˮ�Ƴ�100mL��Һ�������Һ��c��Na����=0.5mol/L�������Һ�м���һ��������ǡ����ȫ��Ӧ������Һ���ɺ����ù�������Ϊ
A. 2.93 g B. 5.85 g C. 6.56g D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�Ļ���ԭ�ϣ����ø����Ʊ���Ԫ��������ɫ��ѧҪ��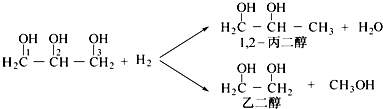
����1��2�����������Ƶ����ᡲCH3CH��OH��COOH����������������Ӧ�е�ijһ����B���Է�Ӧ��ת����ϵ���£���֪A��̼ԭ������������ͬ��E��FΪ��״�߷��ӻ������ش��������⣺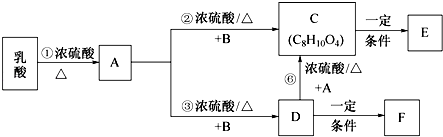
��1����Ӧ�ٵķ�Ӧ��������Ӧ��A������������������ ��
��2��B��һ�������·�Ӧ���ɷ���ʽΪC2H4O���л�������ʲ��ܷ���������Ӧ���˴Ź���������ֻ��һ���壬д�������ʵĽṹ��ʽ ��
��3��F�������õĹ�ѧ���ܺ���ˮ�Կ���Ϊ�����۾��IJ��ϣ�д����D�Ʊ�F�Ļ�ѧ����ʽ ��
��4��д��1��2���������Ʊ�����ĺϳ�·�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��ȵ�����ʹ����100mL���ֱ��������Zn��Ӧ����ͬ����������H2�����V�����ᣩV�����ᣩ�����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ϊ98%���ܶ�Ϊ1.84g/mL��Ũ����������480mL0.2mol/L ��ϡ���ᡣ�ɹ�ѡ���������: �ٲ���������ƿ���ձ��ܽ�ͷ�ιܢ���Ͳ������ƿ��������ƽ��ҩ�ס������������:
(1)���������У�������ϡ����ʱ����Ҫ�õ�����______ (���������)��
(2)���ƹ�������ѡ�õ�����ƿ���Ϊ_____mL,�������㣬��Ҫ��ȡ��Ũ�������Ϊ_____mL��
(3)�����ƹ����У����в���ʹ������ҺŨ��ƫ�ߵ���______ (����ĸ)��
a.δϴ��ϡ��Ũ�������õ��ձ��Ͳ�����
b.Ϊ��ֹ���ʣ�ϡ�ͺ��������Һ������ת�Ƶ�����ƿ��
C.��Һǰ������ƿ�к�����������ˮ
d.����ʱ�����ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ�����X��������ѧ��ѧ�г��������ʣ���ת����ϵ��ͼ��ʾ�����X�������ǣ� ��
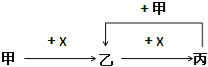
A. ��ΪC��XΪO2 B. ��ΪSO2��XΪNaOH��Һ
C. ��ΪFe��XΪCl2 D. ��ΪAlCl3��XΪNaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Ի�ѧƽ���Ӱ�죬�õ���ͼ��ʾ�仯���ɣ�p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ������� 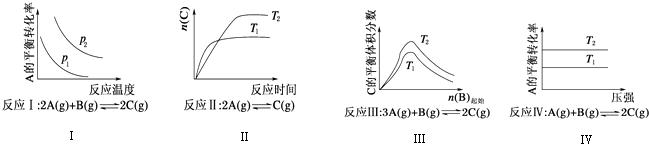
�������Ϲ����жϣ����н�����ȷ���ǣ� ��
A.��Ӧ��H��0��p2��p1
B.��Ӧ��H��0��T2��T1���H��0��T2��T1
C.��Ӧ��H��0��T1��T2
D.��Ӧ������H��0��T2��T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.�� AgCl ����ˮ�в��ܵ��磬�� AgCl ���ǵ����
B.CO2����ˮ�õ�����Һ�ܵ��磬�� CO2���ڷǵ����
C.�����ܵ��磬���Խ����ǵ����
D.Һ̬ HCl �����磬 HCl ���ڷǵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com