
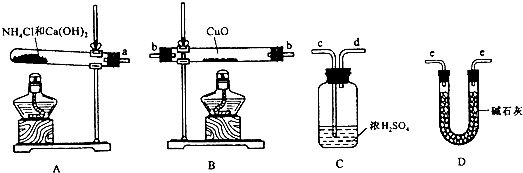
| 18a |
| b |
| ||
| a |
| Ar(Cu)+16 |
| b |
| 18 |
| 18a-16b |
| b |
| 18a |
| b |
| 18a |
| b |
| 18a |
| b |
| ||


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
| A、生成的氢气中只含有H2 |
| B、生成的氢气中只含有D2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br-、Fe2+、I- |
| B、Br-、I-、Fe2+ |
| C、I-、Fe2+、Br- |
| D、Fe2+、I-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
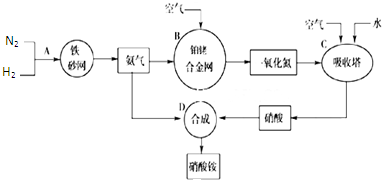
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-=NO2-+H2O |
| D、向碳酸氢钙溶液中加入少量的氢氧化钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
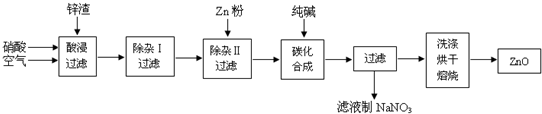
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 使用试剂 | 判断方法 |
| ① | 铁粉 | 如果有气泡,表明盐酸已经过量 |
| ② | pH试纸 | 如果pH<7,表明盐酸已经过量 |
| ③ | 硝酸银溶液 | 如果有白色沉淀产生,表明盐酸已经过量 |
| ④ | 紫色石蕊试液 | 如果溶液变成红色,表明盐酸已经过量 |
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com