
【题目】下列有关性质比较不正确的是( )
A.晶体熔点的高低: 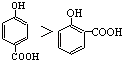
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: .
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放.NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式: .
(3)Cu与稀硝酸反应制备NO的离子方程式 .
(4)实验室常用铵盐和碱的混合物制取氨气,写出化学方程式 设计实验检验铵盐溶液中的阳离子,写出实验操作、现象和结论. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取3.38g K2CO3和KHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mL Ba(OH)2溶液恰好使生成白色沉淀的量最多.反应后溶液的c(OH﹣)=0.8mol/L(忽略混合后溶液体积变化).则原混合物中K2CO3和KHCO3 物质的量之比为( )
A.1:2
B.1:1
C.2:1
D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明氯酸钾晶体中含有氯元素,选用给出的试剂和操作,其操作顺序正确的是
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀HNO3 ⑥与浓盐酸反应 ⑦加NaOH溶液加热 ⑧用淀粉碘化钾
A. ④②③①⑤ B. ⑥⑧ C. ⑥⑦①⑤ D. ②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
Ⅰ.NaCN与NaClO反应,生成NaOCN和NaCl
Ⅱ.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10﹣10)有剧毒;HCN、HOCN中N元素的化合价相同.
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为(选填“酸性”、“碱性”或“中性”);原因是 .
(2)写出第二次氧化时发生反应的离子方程式.
(3)处理100m3含NaCN10.3mg/L的废水,实际至少需NaClOg(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准.
(4)(CN)2与Cl2的化学性质相似.(CN)2与NaOH溶液反应生成、和H2O.
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是;H、C、N、O、Na的原子半径从小到大的顺序为 .
(6)HCN是直线型分子,HCN是分子(选填“极性”或“非极性”).HClO的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 原子最外层电子数为2的元素一定处于周期表IIA族
B. 原子序数相差2的两元素不可能处于同一主族
C. 可根据氢化物的稳定性和酸性强弱,来判断非金属元素得电子能力强弱
D. 非金属元素的最高化合价不超过其元素电子的最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的制备和转化正确的是
A.常温下,用铝与浓硫酸反应制备二氧化硫
B.氯化钡溶液中通入二氧化硫可生成BaSO3沉淀
C.用FeS除去废水中的重金属铜离子
D.以粗铜作阴极,硫酸铜溶液为电解质溶液电解精炼铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( ) 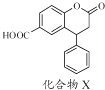
A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1 mol化合物X最多能与2 molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com