
 、-COOH四种基团两两组合而成的化合物中,其水溶液能使石蕊变红的有( )
、-COOH四种基团两两组合而成的化合物中,其水溶液能使石蕊变红的有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫常用来漂白纸浆 | B. | 漂粉精可用于游泳池的消毒 | ||
| C. | 明矾常用于水质消毒 | D. | 氧化铁常用作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
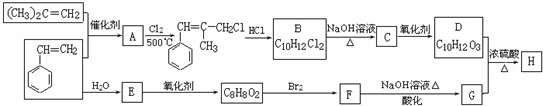
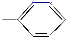
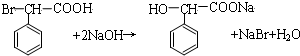 .
.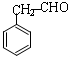 .
.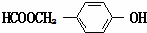 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 光照下能够发生取代反应 | ||
| C. | 正丁烷的沸点比丙烷低 | D. | 丙烷不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 离子半径 | 电负性 | 熔点 | 酸性 |
| O2-> Na+ | F>O | 金刚石> 晶体硅 | H2SO4<HClO4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com