
组别 | 甲 | 乙 | 丙 |
| A | NO | NH3 | H2O |
| B | CO2 | Na2CO3 | Ba(OH)2 |
| C | Al | Fe2O3 | HCl |
| D | Cl2 | FeCl2 | Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、NO不溶于水;
B、CO2是酸性氧化物,能和Na2CO3反应生成NaHCO3,能和碱反应;
C、Al和Fe2O3能发生铝热反应,Fe2O3是碱性氧化物,能和酸反应;
D、Cl2是酸性气体,能和碱反应,Cl2有强氧化性,能和还原性物质反应.
解答 解:A、NO不溶于水,与水不反应,故A选;
B、CO2是酸性氧化物,能和碱Ba(OH)2反应:CO2+Ba(OH)2=BaCO3↓+H2O;CO2能与Na2CO3反应生成NaHCO3:CO2+Na2CO3+H2O=2NaHCO3;Na2CO3能和Ba(OH)2反应:Na2CO3+Ba(OH)2=BaCO3+2NaOH,故三者相互之间反应,故B不选;
C、Al和Fe2O3能发生铝热反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;Fe2O3是碱性氧化物,能和酸反应:Fe2O3+6HCl=2FeCl3+3H2O;铝能和盐酸反应:2Al+6HCl=2AlCl3+3H2↑,故三者相互之间能反应,故C不选;
D、Cl2是酸性气体,能和碱反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;Cl2有强氧化性,能和还原性物质FeCl2反应:2FeCl2+Cl2=2FeCl3;FeCl2能和Ca(OH)2反应生成Fe(OH)2沉淀:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2,即三者相互之间能反应,故D不选.
故选A.
点评 本题考查了物质之间的相互反应,应注意的是NO是一种不溶于水的无色气体,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
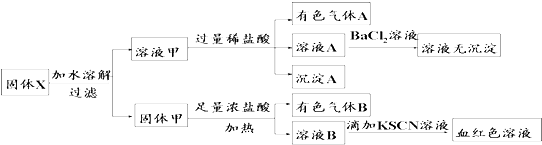
| A. | 溶液甲中一定含有K2SiO3、NaNO2、K2CO3,可能含有KAlO2 | |
| B. | 固体粉末X中可能含有K2SO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中可能含有Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
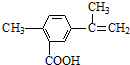
| A. | 在一定条件下,能发生取代、氧化、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与4 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 0.1 mol Fe与足量稀HNO3反应,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
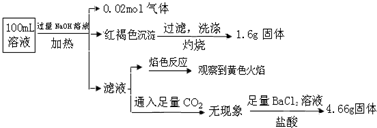
| A. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol•L-1 | |
| B. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| C. | SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在 | |
| D. | 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 体积 | 起始物质 | 平衡时C的物质的量 | 平衡时B的体积分数 | 平衡常数 |
| 甲 | 1L | 1molA+2molB | 1mol | φ甲 | K甲 |
| 乙 | 1L | 4molC+2molD | n1 mol | φ乙 | K乙 |
| 丙 | 2L | 4molC+2molD | n2 mol | φ丙 | K丙 |
| A. | 在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大 | |
| B. | K甲=K丙>K乙 | |
| C. | 升高甲的温度,可使φ甲=φ乙 | |
| D. | n1=1.6,n2=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.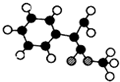
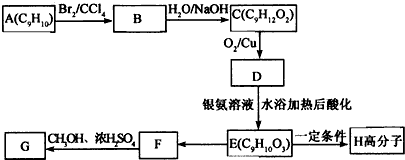
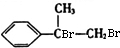 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$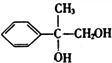 +2NaBr
+2NaBr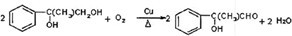
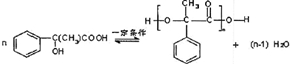
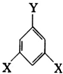 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式: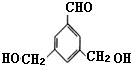 、
、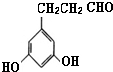 、
、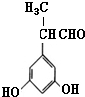 、
、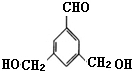 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
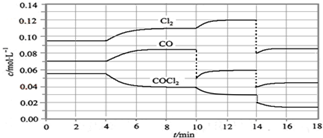
| A. | 从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol•L-1•min-1 | |
| B. | 第8 min时与第18 min时反应的平衡常数不相同 | |
| C. | 在第14 min时,改变的条件可能是压缩反应容器的体积 | |
| D. | CO在2-3min、12-13min和16-18min时平均反应速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com