
分析 根据A2+的电子层结构计算出核外电子数,从而得出原子序数;B、C、D、E按要求写出核外电子排布式,再进行判断.
解答 解:A2+的电子层结构为1S22S22P63S23P63d5,可以得出A2+的电子数目为23个,所以A原子的电子数目为25,所以A元素为25号元素Mn;
B原子的M层为最外层且有两个未成对电子所以B原子的核外电子排布为1S22S22P63S23P2或1S22S22P63S23P4,所以B元素可能为S或Si;
C原子的L电子层的P轨道上有一个空轨道所以C原子的核外电子排布为1S22S22P2,所以C元素为C;
D原子的L电子层的P轨道上只有一对成对电子可以得出D原子的核外电子排布为1S22S22P4,所以D元素为O;
E原子的M电子层的P轨道半充满,则E元素原子的核外电子排布为1S22S22P63S23P3,所以E元素为P;
故答案为:Mn;S或Si;C;0;P.
点评 本题考查核外电子排布规律,关键是结合泡利原理和洪特规则推断是解题关键,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
| J | ||||
| R |
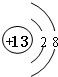 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
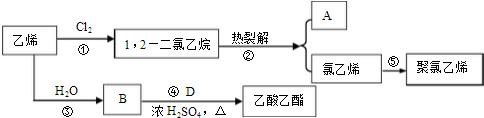
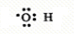 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
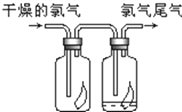 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式,并用双线桥画出电子转移的方向和数目.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ③④⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 200mL | C. | 220mL | D. | 240mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com