
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免_________________。
(2)Br2可用热空气吹出,其原因是________________________________________。
(3)写出步骤③所发生的化学反应方程式___________________________________。
用硫酸而不用盐酸酸化的原因可能是______________。步骤②的产品有时运输到目的地后再酸化,主要是因为________________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中
________________________________________________________________________
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液
 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO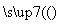 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性______(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是______。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此铅氧化物的化学式是( )
A.PbO B.Pb2O3
C.Pb3O4 D.PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪些事实或实验能说明氧化性:Cl2>Br2>I2__________________________________
(填序号)。
①氯水分别滴入KBr、NaI溶液中颜色加深,而溴水滴入NaCl溶液中无明显变化,滴入KI淀粉溶液中,溶液变蓝
②H2和Cl2的混合气体光照爆炸,H2和Br2的混合气体加热才能反应,而H2和I2反应更困难
③Fe分别与Cl2、Br2、I2反应生成Fe的化合物的化合价高低
④HCl、HBr、HI的热稳定性越来越差
⑤Cl2、Br2、I2在水中的溶解度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示:

回答下列问题:
(1)混合①中发生反应的离子方程式为_________________________________________
________________________________________________________________________。
(2)混合②中加入试剂a是________________________。
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是____________________________(请用离子方程式表示)。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是____(填字母)。
a.KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.淀粉KI溶液
e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是( )
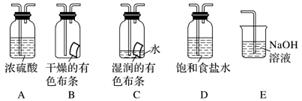
A.按气流流动的先后顺序,装置连接顺序依次为DACBE
B.按气流流动的先后顺序,装置连接顺序依次为DABAE
C.装置E的主要用途是制备NaClO
D.若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填序号)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量NaOH固体,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途。工业上通过氯碱工业生产氯气,其反应的离子方程式为________________________________。室温下,用惰性电极电解100 mL饱和食盐水,当阴极产生标准状况下11.2 mL气体,忽略溶液体积的变化时,所得溶液的pH=______。
(3)常温下,已知25 ℃时有关弱酸的电离常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, K2=5.6×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________________________________________________________。
若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因________________________________________________________________________
________________________________________________________________________。
(4)服用含碘化钾的碘药片可抗核辐射。将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色。完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):______+______+______—→______HIO3+______。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A的各级电离能数据如下:
| I1 | I2 | I3 | I4 | I5 | I6 | |
| I/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 578 | 14 831 | 18 378 |
则元素A的常见价态是( )
A.+1 B.+2 C.+3 D.+6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com