
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)。 (2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式____________________________________________。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___________________________。
科目:高中化学 来源: 题型:
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是 ( )

A.反应①是加成反应 B.只有反应②是加聚反应
C.反应④⑤⑥是取代反应 D.只有反应⑦是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
可用于判断NaHCO3粉末中混有Na2CO3的实验方法是
A.加热时有气体放出
B.滴加盐酸时有无气泡生成
C.溶于水后滴加氯化钡溶液,有白色沉淀生成
D.溶于水后滴加澄清石灰水,有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氰化亚铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。
假设2:红色粉末是Cu2O。
假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含二氰化二铁。你认为这种说法合
理吗? 。简述你的理由(不需写出反应的化学方程式): 。
(3)若同体粉末完伞溶解尢同体存在.滴加KSCN试剂时溶液不变红色.则证明原同体粉末是 ,写出发生的氧化还原反应的离子方程式: 。
【探究延伸】
(4)绎实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。纤杏阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
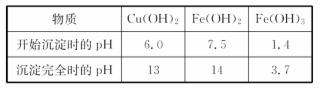
实验小组设汁如下实验方案:
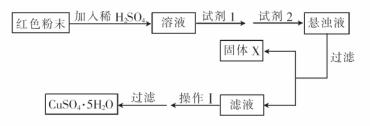
①试剂1为 .试剂2为 . (填字母)
A.氯水 B.H2O2 C.NaOH
②同体X的化学式为 。
③操作II为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
 |
实验步骤
① 取5.0 mL苯胺(密度1.04 g/mL),倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.0 mL乙酸酐(密度1.08 g/mL),搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
② 反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③ 将粗产品转移至150 mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品。
(1)步骤①研碎块状产物的用意在于 ;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有 ;
A.反应快结束时的充分搅拌 B.旋摇下分批加入6.0 mL乙酸酐
C.玻璃棒将块状物研碎 D.加20ml水
(2)步骤②洗涤粗产品时,选用的溶剂是 ;
A.热水 B.冷水 C.1:3的乙醇溶液 D.滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择 (过滤、趁热过滤或抽滤),过滤Ⅰ操作是为了除去 ;配制热溶液时,加入过量溶剂的作用是
(选出正确选项);
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时可选择 ;
A.冰水浴冷却 B.搅拌下水浴冷却
C.室温下自然冷却 D.投入少量碎冰后静置
(5)步骤③中以下哪些操作不能提高产率 ;
① 配制成饱和溶液后,加入过量20%的溶剂;② 趁热过滤近沸溶液;③ 过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;④ 加活性炭吸附;⑤ 过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体。
A.①④⑤ B.①④ C.④⑤ D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93g/mol、102g/mol、135g/mol。该实验的产率为 (保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com