
 ӢK
”¢K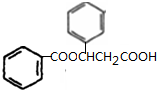 £»
£» $”ś_{”÷}^{ÅØĮņĖį}$
$”ś_{”÷}^{ÅØĮņĖį}$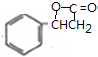 +H2O£¬·“Ó¦ĄąŠĶČ”“ś·“Ó¦»ņõ„»Æ·“Ó¦£»
+H2O£¬·“Ó¦ĄąŠĶČ”“ś·“Ó¦»ņõ„»Æ·“Ó¦£»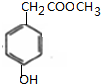 £®
£® ·ÖĪö AÖŠC”¢HŌŖĖŲŌ×ÓøöŹż·Ö±šĪŖ$\frac{166”Į65.1%}{12}$=9”¢$\frac{166”Į6%}{1}$=10£¬OŌ×ÓøöŹż=$\frac{166”Į£Ø1-65.1%-6%£©}{16}$=3£¬
ŌņAµÄ·Ö×ÓŹ½ĪŖC9H10O3£»AÖŠ²»±„ŗĶ¶Č=$\frac{9”Į2+2-10}{2}$=5£¬±½»·µÄ²»±„ŗĶ¶ČŹĒ4£¬ĖłŅŌ»¹ŗ¬ÓŠŅ»øöĖ«¼ü£¬AÖŠŗ¬±½»·ĒŅ±½»·ÉĻÖ»ÓŠŅ»øöÖ§Į“£¬AŌŚŅ»¶ØĢõ¼žĻĀÄÜŹ§Č„Ņ»øöĖ®·Ö×ÓÉś³ÉL£¬LÖŠŗ¬ÓŠŅ»øöĮłŌŖ»·ŗĶŅ»øöĖÄŌŖ»·£¬ŌņAµÄ½į¹¹¼ņŹ½ĪŖ £¬LĪŖ
£¬LĪŖ £¬A·“Ӧɜ³ÉB£¬BÄÜ·¢ÉśĢāøųŠÅĻ¢µÄŃõ»Æ·“Ó¦£¬ŌņBÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬A·¢ÉśĻūČ„·“Ӧɜ³ÉB£¬BĪŖ
£¬A·“Ӧɜ³ÉB£¬BÄÜ·¢ÉśĢāøųŠÅĻ¢µÄŃõ»Æ·“Ó¦£¬ŌņBÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬A·¢ÉśĻūČ„·“Ӧɜ³ÉB£¬BĪŖ £¬B”¢EŹĒĶ¬·ÖŅģ¹¹Ģ壬ŌņBŗĶĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉE£¬EĪŖ
£¬B”¢EŹĒĶ¬·ÖŅģ¹¹Ģ壬ŌņBŗĶĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉE£¬EĪŖ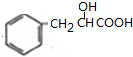 £¬EŹ§Č„Į½·Ö×ÓĖ®Éś³ÉF£¬FŹĒŗ¬ÓŠČżøöĮłŌŖ»·µÄ»ÆŗĻĪļ£¬FĪŖ
£¬EŹ§Č„Į½·Ö×ÓĖ®Éś³ÉF£¬FŹĒŗ¬ÓŠČżøöĮłŌŖ»·µÄ»ÆŗĻĪļ£¬FĪŖ £»K”¢IŹĒõ„»Æ·“Ó¦µÄ²śĪļ£¬BÉś³ÉµÄCŗĶD¶¼ŹĒČ©£¬C”¢D±»Ńõ»ÆÉś³ÉG”¢H£¬G”¢HŹĒōČĖį£¬KÖŠŗ¬ÓŠ16øöCŌ×Ó”¢4øöOŌ×Ó£¬ŌņG”¢AŅŌ1£ŗ1·“Ӧɜ³ÉK£¬ŌņCĪŖ
£»K”¢IŹĒõ„»Æ·“Ó¦µÄ²śĪļ£¬BÉś³ÉµÄCŗĶD¶¼ŹĒČ©£¬C”¢D±»Ńõ»ÆÉś³ÉG”¢H£¬G”¢HŹĒōČĖį£¬KÖŠŗ¬ÓŠ16øöCŌ×Ó”¢4øöOŌ×Ó£¬ŌņG”¢AŅŌ1£ŗ1·“Ӧɜ³ÉK£¬ŌņCĪŖ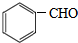 £¬GĪŖ
£¬GĪŖ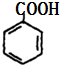 £¬DĪŖOHCCHO£¬HĪŖHOOCCOOH£¬KĪŖ
£¬DĪŖOHCCHO£¬HĪŖHOOCCOOH£¬KĪŖ £¬HŗĶAŅŌ1£ŗ2·“Ӧɜ³ÉI£¬IĪŖ
£¬HŗĶAŅŌ1£ŗ2·“Ӧɜ³ÉI£¬IĪŖ £¬¾Ż“Ė·ÖĪö½ā“š£®
£¬¾Ż“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗAÖŠC”¢HŌŖĖŲŌ×ÓøöŹż·Ö±šĪŖ$\frac{166”Į65.1%}{12}$=9”¢$\frac{166”Į6%}{1}$=10£¬OŌ×ÓøöŹż=$\frac{166”Į£Ø1-65.1%-6%£©}{16}$=3£¬
ŌņAµÄ·Ö×ÓŹ½ĪŖC9H10O3£»AÖŠ²»±„ŗĶ¶Č=$\frac{9”Į2+2-10}{2}$=5£¬±½»·µÄ²»±„ŗĶ¶ČŹĒ4£¬ĖłŅŌ»¹ŗ¬ÓŠŅ»øöĖ«¼ü£¬AÖŠŗ¬±½»·ĒŅ±½»·ÉĻÖ»ÓŠŅ»øöÖ§Į“£¬AŌŚŅ»¶ØĢõ¼žĻĀÄÜŹ§Č„Ņ»øöĖ®·Ö×ÓÉś³ÉL£¬LÖŠŗ¬ÓŠŅ»øöĮłŌŖ»·ŗĶŅ»øöĖÄŌŖ»·£¬ŌņAµÄ½į¹¹¼ņŹ½ĪŖ £¬LĪŖ
£¬LĪŖ £¬A·“Ӧɜ³ÉB£¬BÄÜ·¢ÉśĢāøųŠÅĻ¢µÄŃõ»Æ·“Ó¦£¬ŌņBÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬A·¢ÉśĻūČ„·“Ӧɜ³ÉB£¬BĪŖ
£¬A·“Ӧɜ³ÉB£¬BÄÜ·¢ÉśĢāøųŠÅĻ¢µÄŃõ»Æ·“Ó¦£¬ŌņBÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬A·¢ÉśĻūČ„·“Ӧɜ³ÉB£¬BĪŖ £¬B”¢EŹĒĶ¬·ÖŅģ¹¹Ģ壬ŌņBŗĶĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉE£¬EĪŖ
£¬B”¢EŹĒĶ¬·ÖŅģ¹¹Ģ壬ŌņBŗĶĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉE£¬EĪŖ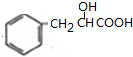 £¬EŹ§Č„Į½·Ö×ÓĖ®Éś³ÉF£¬FŹĒŗ¬ÓŠČżøöĮłŌŖ»·µÄ»ÆŗĻĪļ£¬FĪŖ
£¬EŹ§Č„Į½·Ö×ÓĖ®Éś³ÉF£¬FŹĒŗ¬ÓŠČżøöĮłŌŖ»·µÄ»ÆŗĻĪļ£¬FĪŖ £»K”¢IŹĒõ„»Æ·“Ó¦µÄ²śĪļ£¬BÉś³ÉµÄCŗĶD¶¼ŹĒČ©£¬C”¢D±»Ńõ»ÆÉś³ÉG”¢H£¬G”¢HŹĒōČĖį£¬KÖŠŗ¬ÓŠ16øöCŌ×Ó”¢4øöOŌ×Ó£¬ŌņG”¢AŅŌ1£ŗ1·“Ӧɜ³ÉK£¬ŌņCĪŖ
£»K”¢IŹĒõ„»Æ·“Ó¦µÄ²śĪļ£¬BÉś³ÉµÄCŗĶD¶¼ŹĒČ©£¬C”¢D±»Ńõ»ÆÉś³ÉG”¢H£¬G”¢HŹĒōČĖį£¬KÖŠŗ¬ÓŠ16øöCŌ×Ó”¢4øöOŌ×Ó£¬ŌņG”¢AŅŌ1£ŗ1·“Ӧɜ³ÉK£¬ŌņCĪŖ £¬GĪŖ
£¬GĪŖ £¬DĪŖOHCCHO£¬HĪŖHOOCCOOH£¬KĪŖ
£¬DĪŖOHCCHO£¬HĪŖHOOCCOOH£¬KĪŖ £¬HŗĶAŅŌ1£ŗ2·“Ӧɜ³ÉI£¬IĪŖ
£¬HŗĶAŅŌ1£ŗ2·“Ӧɜ³ÉI£¬IĪŖ £¬
£¬
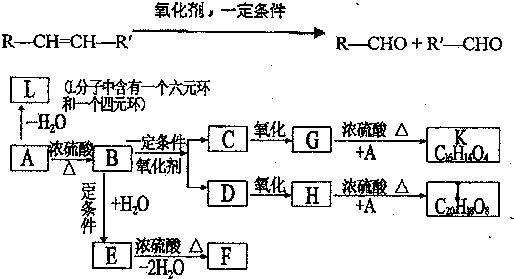
£Ø1£©AµÄ·Ö×ÓŹ½ĪŖC9H10O3£¬AµÄ½į¹¹¼ņŹ½ĪŖ £¬AÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³Ę“¼ōĒ»łŗĶōČ»ł£¬¹Ź“š°øĪŖ£ŗC9H10O3£»“¼ōĒ»łŗĶōČ»ł£»
£¬AÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³Ę“¼ōĒ»łŗĶōČ»ł£¬¹Ź“š°øĪŖ£ŗC9H10O3£»“¼ōĒ»łŗĶōČ»ł£»
£Ø2£©BµÄ½į¹¹¼ņŹ½ĪŖ ”¢KµÄ½į¹¹¼ņŹ½ĪŖ
”¢KµÄ½į¹¹¼ņŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£» £»
£»
£Ø3£©AµÄ½į¹¹¼ņŹ½ĪŖ ”¢LĪŖ
”¢LĪŖ £¬A·¢Éśõ„»Æ·“Ó¦»ņČ”“ś·“Ӧɜ³ÉL£¬·“Ó¦ĄąŠĶŹĒČ”“ś·“Ó¦»ņõ„»Æ·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖ
£¬A·¢Éśõ„»Æ·“Ó¦»ņČ”“ś·“Ӧɜ³ÉL£¬·“Ó¦ĄąŠĶŹĒČ”“ś·“Ó¦»ņõ„»Æ·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖ $”ś_{”÷}^{ÅØĮņĖį}$
$”ś_{”÷}^{ÅØĮņĖį}$ +H2O£¬
+H2O£¬
¹Ź“š°øĪŖ£ŗ $”ś_{”÷}^{ÅØĮņĖį}$
$”ś_{”÷}^{ÅØĮņĖį}$ +H2O£»Č”“ś·“Ó¦»ņõ„»Æ·“Ó¦£»
+H2O£»Č”“ś·“Ó¦»ņõ„»Æ·“Ó¦£»
£Ø4£©AĪŖ £¬AµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåM£¬Ęä±½»·ÉĻÓŠĮ½øö¼äĪ»Č”“ś»ł£¬ĒŅÄÜÓėČżĀČ»ÆĢśČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠ·ÓōĒ»ł£¬MÄÜĖ®½āĖµĆ÷ŗ¬ÓŠõ„»ł£¬MĖ®½āÉś³ÉXŗĶY£¬YŹĒŅūÓĆ¼Ł¾ĘÖĀČĖŹ§Ć÷”¢ÉõÖĮĖĄĶöµÄŌŖŠ×£¬ŌņYĪŖCH3OH£¬YĪŖ
£¬AµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåM£¬Ęä±½»·ÉĻÓŠĮ½øö¼äĪ»Č”“ś»ł£¬ĒŅÄÜÓėČżĀČ»ÆĢśČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠ·ÓōĒ»ł£¬MÄÜĖ®½āĖµĆ÷ŗ¬ÓŠõ„»ł£¬MĖ®½āÉś³ÉXŗĶY£¬YŹĒŅūÓĆ¼Ł¾ĘÖĀČĖŹ§Ć÷”¢ÉõÖĮĖĄĶöµÄŌŖŠ×£¬ŌņYĪŖCH3OH£¬YĪŖ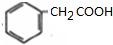 £¬ŌņMĪŖ
£¬ŌņMĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļĶʶĻ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪöĶʶĻŅŌ¼°ÖŖŹ¶×ŪŗĻÓ¦ÓĆÄÜĮ¦£¬ÕżČ·ÅŠ¶ĻA½į¹¹¼ņŹ½ŹĒ½ā±¾Ģā¹Ų¼ü£¬ŌŁ½įŗĻ·“Ó¦Ģõ¼ž”¢Éś³ÉĪļ·Ö×ÓŹ½»ņ½į¹¹ĢŲµć½ųŠŠĶʶĻ£¬ÄѵćŹĒĶ¬·ÖŅģ¹¹ĢåÅŠ¶Ļ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øõ”¢ĆĢ | B£® | øõ”¢¹č | C£® | øõ”¢Äų | D£® | øõ”¢Ģ¼ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¾Ż·“Ó¦¢ŁæÉÖŖN2µÄČ¼ÉÕČČĪŖ180 kJ•mol-1 | |
| B£® | 2H2O£Øl£©ØT2H2£Øg£©+O2£Øg£©”÷H£¾+483.6 kJ•mol-1 | |
| C£® | ·“Ó¦¢ŚŌŚŗćĪĀŗćČŻĆܱÕČŻĘ÷·“Ó¦“ļĘ½ŗāŗ󣬳äČėN2£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬µŖĘųµÄ×Ŗ»ÆĀŹ¼õŠ”£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżŌö¼Ó | |
| D£® | æÉĶĘÖŖ£¬°±µÄ“ß»ÆŃõ»ÆµÄČČ»Æѧ·½³ĢŹ½ĪŖ4NH3£Øg£©+5O2£Øg£©ØT4NO£Øg£©+6H2O£Øl£©”÷H=-906 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “ÓCH4”¢NH4+”¢SO42-ĪŖÕżĖÄĆęĢå½į¹¹£¬æÉĶĘ²āPH4+”¢PO43-Ņ²ĪŖÕżĖÄĆęĢå½į¹¹ | |
| B£® | NaClÓėCsCl»ÆѧŹ½ĻąĖĘ£¬¹ŹNaClÓėCsClµÄ¾§Ģå½į¹¹Ņ²ĻąĖĘ | |
| C£® | ±½²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬¹Ź±½µÄĶ¬ĻµĪļŅ²²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ« | |
| D£® | CO2ĶØČėCa£ØClO£©2ČÜŅŗÉś³ÉCaCO3ŗĶHClO£¬SO2ĶØČėCa£ØClO£©2ČÜŅŗŅ²Éś³ÉCaSO3ŗĶHClO |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼×Č©ŗĶŅŅČ© | B£® | ±ūĻ©Č©ŗĶ±½¼×Č© | C£® | ŅŅĖįŗĶ¼×Ėį¼×õ„ | D£® | ¼×Č©ŗĶĘĻĢŃĢĒ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ŹµŃé ½šŹō | G | L | M | R |
| ŗĶĄäĖ®·“Ó¦ | ĪŽ·“Ó¦ | ĀżĀż·“Ó¦ | Ī“×ö | Ī“×ö |
| ŗĶ2mol/L HCl ·“Ó¦ | Čܽā²¢·Å³öĘųĢå | Čܽā²¢·Å³öĘųĢå | ĪŽ·“Ó¦ | ĪŽ·“Ó¦ |
| ŗĶRn+µÄĖ®ČÜŅŗ·“Ó¦ | Čܽā²¢ŠĪ³É³Įµķ | Ī“×ö | Čܽā²¢ŠĪ³É³Įµķ | Ī“×ö |
| A£® | L”¢G”¢R”¢M | B£® | G”¢L”¢M”¢R | C£® | L”¢G”¢M”¢R | D£® | L”¢R”¢G”¢M |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŃÖŖC£Øs£©+O2£Øg£©ØTCO2£Øg£©”÷H1£»C£Øs£©+$\frac{1}{2}$O2£Øg£©ØTCO £Øg£©”÷H2£¬Ōņ”÷H1£¾”÷H2 | |
| B£® | ŌŚĻ”ČÜŅŗÖŠ£¬H+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3kJ•mol-1£¬Čō½«ŗ¬0.5molH2SO4µÄÅØĮņĖįÓėŗ¬1mol NaOHµÄČÜŅŗ»ģŗĻ£¬·Å³öµÄČČ“óÓŚ57.3 kJ | |
| C£® | ÓÉC£ØŹÆÄ«£©ØTC£Ø½šøÕŹÆ£©£»”÷H=+1.90kJ•mol-1æÉÖŖ£¬½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø | |
| D£® | ŅŃÖŖĒāĘųµÄ±ź×¼Č¼ÉÕČČĪŖ-285.8 kJ•mol-1£¬ĻąÓ¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=-285.8kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com