
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.![]() 含有的电子数为NA
含有的电子数为NA
B.标准状况下,![]() 的
的![]() 中含有的氯原子数为0.4NA
中含有的氯原子数为0.4NA
C.常温常压下,![]() 葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA
葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA
D.标准状况下,![]() 的乙烯所含碳原子的个数为0.4NA
的乙烯所含碳原子的个数为0.4NA
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】已知pC=-lgc(B),室温下,某二元酸(H2A)中部分微粒的pC值随溶液pH值变化关系如图所示。下列说法错误的是( )

A.曲线a表示的微粒是H+
B.溶液中水的电离程度:m>n
C.pH=8时,溶液中,c(HA-)>c(H2A)
D.pH=1与pH=3时,H2A的浓度几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
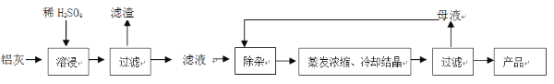
(一定条件下,![]() 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是_______________;
(2)检验滤液中还存在Fe2+的方法是____________(注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的_________;调节溶液的pH为3.2的目的是__________。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是______,写出其反应方程式________________;
③Ⅲ中加入MnSO4的目的是__________。
(4)从多次循环使用后母液中可回收的主要物质是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是三种常见有机物的比例模型示意图.下列说法正确的是( )

A. 甲在光照条件下与Cl2反应可得到四种不同的产物
B. 乙、丙所有的原子均处于同一平面,均可使溴水反应褪色
C. 石油分馏可获得甲和乙,煤干馏可获得丙
D. 在浓硫酸存在下,丙与浓硝酸共热的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是
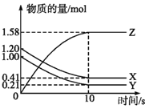
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验;下列预期实验现象及相应结论均正确的是( )

a | b | 预期实验现象 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有( )
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=Fe3++NO↑+3H2O
⑤氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑥Fe(OH)3不可用Fe2O3与水反应得到,但能通过其它化合反应制取
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
| 滴管 | 试管 | |
0.2molL-1 CuSO4溶液 | 0.2molL-1NaI溶液 | Ⅰ.产生白色沉淀和黄色溶液 | |
0.2molL-1Na2CO3溶液 | Ⅱ.产生绿色沉淀和无色无味气体 | ||
0.2molL-1Na2SO3溶液 | Ⅲ.产生棕黄色沉淀 | ||
(1)经检验,现象Ⅰ的白色沉淀为CuI,则反应的离子方程式为___,氧化产物与还原产物的物质的量之比为___。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3yCu(OH)2zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3yCu(OH)2zH2O与氢气反应的化学方程式___;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→___→gf→___→___→___→l

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是___。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。

a.白色沉淀A是BaSO4,试剂Ⅰ是___。
b.证实沉淀中含有Cu2+和SO32-的理由是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com