
【题目】向含![]() 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是

【答案】C
【解析】本题考查氧化还原反应及有关离子反应的计算。离子还原性:![]() >I>Fe2+>Br,故反应依次为:
>I>Fe2+>Br,故反应依次为:![]() +Cl2+H2O
+Cl2+H2O![]()
![]() +2Cl+2H+;2I+Cl2
+2Cl+2H+;2I+Cl2![]() I2+2Cl;2Fe2++Cl2
I2+2Cl;2Fe2++Cl2![]() 2Fe3++2Cl;2Br+Cl2
2Fe3++2Cl;2Br+Cl2![]() Br2+2Cl。A、由
Br2+2Cl。A、由![]() +Cl2+H2O
+Cl2+H2O![]()
![]() +2Cl+2H+可知,0.1 mol
+2Cl+2H+可知,0.1 mol ![]() 完全反应需要消耗0.1 mol氯气,标准状况下Cl2的体积为0.1 mol×22.4 L/mol=2.24 L,错误;B、0.1 mol
完全反应需要消耗0.1 mol氯气,标准状况下Cl2的体积为0.1 mol×22.4 L/mol=2.24 L,错误;B、0.1 mol ![]() 完全反应后,才发生2I+Cl2
完全反应后,才发生2I+Cl2![]() I2+2Cl,0.1 mol I完全反应消耗0.05氯气,体积为0.05 mol×22.4 L/mol=1.12 L,加上
I2+2Cl,0.1 mol I完全反应消耗0.05氯气,体积为0.05 mol×22.4 L/mol=1.12 L,加上![]() 消耗的2.24 L,共3.36 L,错误;C、由2Fe2++Cl2
消耗的2.24 L,共3.36 L,错误;C、由2Fe2++Cl2![]() 2Fe3++2Cl,可知,0.1 mol Fe2+完全反应消耗0.05氯气,体积为1.12 L,加上B中的3.36 L,共4.48 L,正确;D、
2Fe3++2Cl,可知,0.1 mol Fe2+完全反应消耗0.05氯气,体积为1.12 L,加上B中的3.36 L,共4.48 L,正确;D、![]() 、I、Fe2+完全反应时消耗的氯气体积就已经是4.48 L了,错误。答案选C。
、I、Fe2+完全反应时消耗的氯气体积就已经是4.48 L了,错误。答案选C。


科目:高中化学 来源: 题型:
【题目】
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图

缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
(3)B原子的电子有 个不同的能级;晶体硼熔点为2300℃,则其为 晶体。
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼 三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为a pm(即图中立方体的每条边长为 a pm)时,磷化硼中硼原子和磷原子之间的最近距离 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、![]() ,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是
,其中Fe3+、I2的物质的量随通入Cl2的物质的量n(Cl2)的变化如图所示,下列说法不正确的是

A.氧化性强弱:I2<Fe3+<![]()
B.n(Cl2)=0.12 mol时,溶液中的离子主要有:Fe2+、Fe3+、Cl
C.若n(Cl2)∶n(FeI2)=6∶5,反应的离子方程式为2Fe2++10I+6Cl2![]() 5I2+2Fe3++12Cl
5I2+2Fe3++12Cl
D.若n(Cl2)∶n(FeI2)=2∶1,反应的离子方程式为2Fe2++4I+3Cl2![]() 2I2+2Fe3++6Cl
2I2+2Fe3++6Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护水资源刻不容缓。下列属于物理方法处理废水的是( )
A. 用生石灰处理酸性废水
B. 用沉淀剂处理含重金属离子的废水
C. 用稀盐酸处理碱性废水
D. 用沉降法处理废水中的固体颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.10 mol·L-1的氨水滴定10.0mL a mol L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是
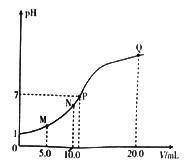
A. a=0.10
B. N、P两点溶液中水的电离程度:N
C. M、N两点溶液中NH4+的物质的量之比大于1:2
D. Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实解释正确的是
选项 | 现象或事实 | 解 释 |
A | 泡沫灭火器灭火 | 3CO32- + 2Al3+ + 3H2O=3CO2↑+ 2Al(OH)3↓ |
B | 施肥时,草木灰与NH4Cl混合使用 | 同时使用氮肥和钾肥效果更好 |
C | 将充满NO2的密闭玻璃球浸在热水中,红棕色变深 | 反应2NO2 |
D | 测定相同浓度的Na2S与Na2SO3溶液的pH | 比较H2S和H2SO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.6 g带铁锈的铁片溶解于25 mL、14 mol/L的热的浓硫酸中,气体只有SO2且体积为1.12 L(标准状况)。将溶液稀释至100 mL,所得溶液遇KSCN溶液时无血红色出现。下列结论正确的是
A.反应中:转移电子3.01×1022个 B.反应后:剩余硫酸0.30 mol
C.原混合物:n(Fe2O3)∶n(Fe)=1∶2 D.所得溶液:c(FeSO4)=1.7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·上海]工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1∶2
C.每生成1 mol Na2S2O3,转移4 mol电子
D.相同条件下,每吸收10 m3 SO2就会放出2.5 m3 CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下RO3—与R—发生如下反应:RO3—+5R—+6 H+=3R2+3H2O,则下列关于R元素的说法中正确的是:( )
A. R位于元素周期表中的第VA族 B. R的氢化物的水溶液呈酸性
C. RO3—中的R元素只能被还原 D. R2在常温常压下一定是气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com