
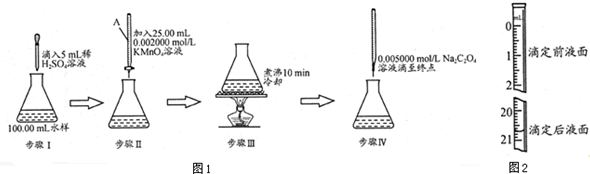
分析 (1)依据仪器的结构和用途分析,高锰酸钾溶液滴定到最后一滴溶液呈紫红色且半分钟不褪说明反应达到终点,溶液呈紫红色;
(2)标注元素化合价结合电子守恒和原子守恒配平书写离子方程式,开始较慢,随后反应速率加快说明生成的锰离子起了催化作用;
(3)滴定后为20.70ml,开始为0.70ml,据此标注;
(4)实验测量结果比实际有机物含量偏高,可能是读取数据时把滴定管中消耗溶液体积读大了;
(5)依据资料卡片中的信息分析判断,不能加入氧化性或形成氧化性的物质,不能消耗高锰酸钾溶液.
解答 解:(1)仪器A为待玻璃活塞的滴定管为酸式滴定管高锰酸钾溶液滴定到最后一滴溶液呈紫红色且半分钟不褪说明反应达到终点,溶液呈紫红色,步骤Ⅲ中溶液颜色应为紫红色;
故答案为:酸式;紫红色;
(2)碳元素化合价+3价变化为+4价,升高做还原剂,锰元素化合价+7价变化为+2价,C2O42-前加系数5,MnO4-前系数加2,电子守恒、电荷守恒、原子守恒配平写出离子方程式为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,说明反应中生成的锰离子对反应起到催化剂的作用,
故答案为:5,2,16,2,10,8H2O;随反应进行Mn2+可能做反应的催化剂;
(3)滴定后为20.70ml,开始为0.70ml,步骤Ⅳ中所用Na2C2O4溶液为20.00mL,则滴定管读数为: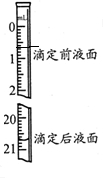
故答案为: ;
;
(4)实验测量结果比实际有机物含量偏高,配制Na2C2O4标液定容时,可能是读取数据时把滴定管中消耗溶液体积读大了;
故答案为:俯视刻度线;
(5)①有机质可HNO3被氧化.②AgCl不与酸性KMnO4溶液反应.③Ag2C2O4可被酸性KMnO4溶液氧化,
AgNO3溶液在酸性溶液中形成稀硝酸具有氧化性,故不符合;
Ag2SO4溶液,加入后可以利用氯化银溶解度小沉淀转化,消除氯离子影响;
KMnO4溶液具有氧化性,不能消除影响;
Na2C2O4溶液可以被高锰酸钾溶液氧化,不能消除;
消除Cl-影响在步骤Ⅰ的水样中加入适量的Ag2SO4溶液;
故答案为:步骤Ⅰ的水样中加入适量的Ag2SO4溶液.
点评 本题考查了物质组成的实验探究方法分析,过程理解应用,主要是物质性质的分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
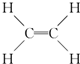 ,B中决定其性质的重要官能团的名称为羟基.
,B中决定其性质的重要官能团的名称为羟基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热法可除去Na2CO3中的NaHCO3 | |
| B. | 硝酸酸化的硝酸银溶液检验Cl- | |
| C. | 可用石灰水区分Na2CO3与NaHCO3溶液 | |
| D. | 热纯碱溶液可除去油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气制备一氯乙烷 | |
| B. | 在FeBr3催化作用下,苯与液溴反应制取溴苯 | |
| C. | 苯和硝酸反应制备硝基苯 | |
| D. | 乙烯与氧气在银催化作用下生成环氧乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>D>B>C | B. | D>A>B>C | C. | D>A>C>B | D. | C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
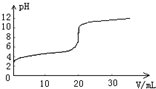 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中始终,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=4时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=6时,c(CH3COO-)+c(CH3COOH)=0.1000 mol•L-1 | |
| D. | pH=7时,消耗NaOH溶液的体积小于20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com