
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:阅读理解
| 加热 |
| 加热 |
| 铜 |
| △ |
| 铜 |
| △ |
查看答案和解析>>
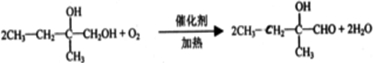
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
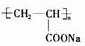
| 催化剂 |
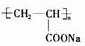
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
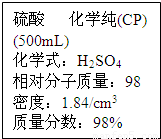
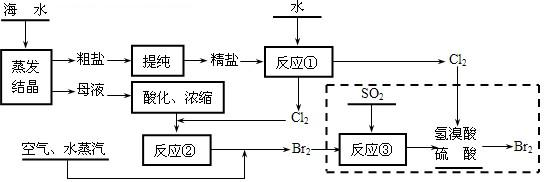
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.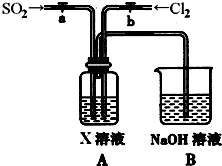
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,如图是一种形状酷似
,如图是一种形状酷似 一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”.
一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”.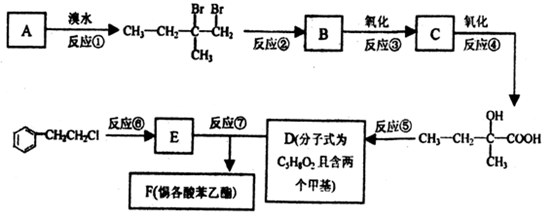
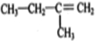
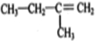



查看答案和解析>>
科目:高中化学 来源:2013届江西省高二下学期期中考试化学试卷(解析版) 题型:实验题
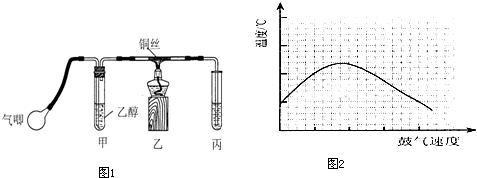
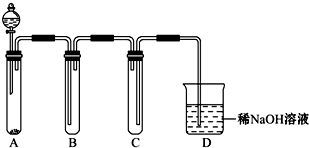
(12分)实验室可利用乙醇、铜或铜的化合物制备乙醛,如图是某兴趣小组设计的实验装置,右侧的反应装置相同,而左侧的气体发生装置不同,试管C中装有水(加热装置未画出),试回答:
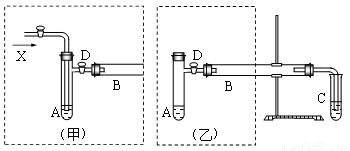
(1) 两套装置中的A、B处都需加热,A处用水浴加热,B处用__________加热,A处用水浴加热的主要优点是__________。
(2) 若按甲装置进行实验,B管处装铜粉,则通入A管的X是__________,B中反应的化学方程式是__________。
(3) 若按乙装置进行实验,则B管中应装__________,B中反应的化学方程式是__________。
(4) 实验结束后,取C试管中的溶液滴入新制备的银氨溶液并采用水浴加热可观察到有银镜生成,写出该过程的离子方程式__________ 。
(5) 实验完成后,应在C试管中加入__________可洗去银镜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com