
元素周期表是学习和研究化学的重要工具。按要求回答下列问题:
A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素A可以和B形成A2B和A2B2两种分子;化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,乙是由元素D与E组成;化合物丙是由C与E组成的。
(1)元素B、D、E的元素符号依次为_______、_______、______。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的有___(填分子式)
(3)D的氧化物在高温下可以与C的碳酸盐发生反应,其化学反应方程式为________;化合物乙遇水剧烈反应有白雾生成,其反应的化学方程式为___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量为________;配制过程中除用到容量瓶外,还需要的玻璃仪器有___________________。电解所配制的400mL溶液,当电路中通过1mol电子时,理论上可收集到的气体在标准状况下的体积为_________L。
(1)O,Si,Cl(每空1分)
(2)H2O2、HCl(对一个给1分) (3)SiO2+Na2CO3 NaSiO3+CO2↑(缺少条件扣1分);
NaSiO3+CO2↑(缺少条件扣1分);
SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)
(4)29.25g(或29.3g),烧杯、玻璃棒、胶头滴管(少1个扣1分,扣完为止);19.04
解析试题分析:A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,说明二者是第IA组元素。C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同。由于非金属性最强的是F,所以C是Na元素。元素A可以和B形成A2B和A2B2两种分子,且B的原子序数小于钠的,因此A和B应该是H和O元素。化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,这说明甲是SiH4,所以D是Si元素。乙是由元素D与E组成。由于E的原子序数等于Si的,所以E是氯元素,即乙是SiCl4;化合物丙是由C与E组成的,则丙是NaCl。
(1)元素B、D、E的元素符号依次为O,Si,Cl。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的还有H2O2、HCl。
(3)在高温下二氧化硅与碳酸钠反应生成硅酸钠和CO2,反应的化学方程式为SiO2+Na2CO3 NaSiO3+CO2↑。SiCl4遇水剧烈反应有白雾生成,这说明反应中有氯化氢生成。根据原子守恒可知同时还有硅酸生成,则其反应的化学方程式为SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)。
NaSiO3+CO2↑。SiCl4遇水剧烈反应有白雾生成,这说明反应中有氯化氢生成。根据原子守恒可知同时还有硅酸生成,则其反应的化学方程式为SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量=0.5L×1mol/L×58.5g/mol=29.25g;配制过程中除用到容量瓶外,还需要的玻璃仪器有烧杯、玻璃棒和胶头滴管。400mL 1mol/L的氯化钠溶液中溶质氯化钠的物质的量=0.4L×1mol/L=0.4mol。电解氯化钠溶液的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。根据方程式可知,每生成1mol氢气和1mol氯气转移2mol电子,消耗2mol氢氧化钠,因此0.4mol氢氧化钠转移0.4mol。由于电路中通过1mol电子,这说明氢氧化钠不足,生成氢气和氯气的物质的量都是0.2mol。电解的后阶段只电解水,转移0.6mol电子。则根据方程式2H2O
2NaOH+H2↑+Cl2↑。根据方程式可知,每生成1mol氢气和1mol氯气转移2mol电子,消耗2mol氢氧化钠,因此0.4mol氢氧化钠转移0.4mol。由于电路中通过1mol电子,这说明氢氧化钠不足,生成氢气和氯气的物质的量都是0.2mol。电解的后阶段只电解水,转移0.6mol电子。则根据方程式2H2O 2H2↑+O2↑可知,转移0.6mol电子时生成0.3mol氢气和0.15mol氧气,所以理论上可收集到的气体在标准状况下的体积为(0.2mol+0.2mol+0.3mol+0.15mol)×22.4L/mol=19.04L。
2H2↑+O2↑可知,转移0.6mol电子时生成0.3mol氢气和0.15mol氧气,所以理论上可收集到的气体在标准状况下的体积为(0.2mol+0.2mol+0.3mol+0.15mol)×22.4L/mol=19.04L。
考点:考查元素推断、18电子微粒、碳酸钠与二氧化硅、四氯化硅的水解反应;氯化钠的配制以及电解氯化钠溶液的有关计算


科目:高中化学 来源: 题型:填空题
将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应。
(1)写出反应的化学方程式: 。
(2)生成的氨气在标准状况下的体积是 L。
(3)若将这些氨气溶于水配成500mL氨水,该氨水的物质的量浓度是 mol·L-1。
(4)在400℃左右且有催化剂存在的情况下,用氨可以把一氧化氮还原成氮气,方程式为:4NH3+6NO=5N2+6H2O,此反应中氧化产物与还原产物的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断B可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)18gH2O的物质的量是 ,含有 个氢原子(填具体数字);这些H2O与 gOH-所含电子数相等。
(2)标准状况下,①6.72L CH4 ②3.01×1023HCl分子 ③0.2molNH3 ,这三种气体按物质的量由大到 小排列的顺序是(填物质的数字代号,下同) ,按氢原子数由多到少排列的顺序是 ,密度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有25℃101KPa条件下的氯化氢(HCl)气体49L(注:25℃101KPa条件下气体摩
尔体积为24.5L/mol)则:
①该气体所含原子总数为________________个。
②该气体的质量为_____________g。
③该气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为______________。④取出20.0 mL该溶液,配成浓度为2.00 mol/L的稀溶液,则稀释后溶液的体积是_________ ml。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的两种或多种。取该溶液100mL,加入过量NaOH溶液,加热,得到448mL(标况)气体,同时产生红褐色沉淀,经过滤、洗涤、灼烧,得到1.6g固体;将上述滤液平均分成两份,一份中加足量BaCl2溶液,得到2.33g不溶于盐酸的沉淀;另一份中通入过量CO2得到1.56g白色沉淀。由此可推断原溶液一定含有的离子种类及其浓度,将结果填入下表(可不填满)。
| 一定含有的离子种类 | | | | | | | |
| 物质的量浓度(mol/L) | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
当三份铜粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸充分反应后,收集到的气体在相同状况下体积相等时(不考虑NO2转化为N2O4 、生成气体溶解及产生水蒸气的体积),其三份铜的质量比为
(2)1.28克铜与适量的浓硝酸反应,铜完全溶解,共收集到672 ml NO、NO2混合气(标准状况),则反应中共消耗HNO3的物质的量为
(3)用20ml 18.4 mol/L浓硫酸和铜共热一段时间后,冷却、过滤,将滤液稀释到100ml,测得溶液中SO42— 的浓度为3.18mol/L,则该溶液CuSO4的物质的量浓度为
(4)Na2SiO3可以改写成氧化物的形式为Na2O·SiO2,则质量分数为98%的浓硫酸改写成氧化物的形式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8:7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示: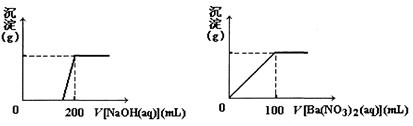
(1)请通过计算确定m的值;
(2)X的摩尔质量为368 g/mol,请确定X的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com