
化学平衡状态I、II、III的相关数据如下表:
编号 | 化学方程式
| 平衡常数 | 温度 | |
979K | 1173K | |||
I | Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
II | CO(g)+H2O(g) | K2 | 1.62 | b |
III | Fe(s)+H2O(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是
A.a>b B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动 D.反应II、III均为放热反应
C
【解析】
试题分析:根据化学平衡常数表达式的书写原则知,K1=[CO]/[CO2], K2=[CO2][H2]/[CO][H2O], K3=[H2]/[H2O],则有相同温度下,K3=K1?K2,979K平衡常数a=1.47×1.62=2.38,1173K平衡常数b=1.68/2.15=0.78。A、根据上述分析知a>b,正确;B、反应Ⅱ是反应前后气体物质的量不变的反应,增大压强平衡不动,正确;C、根据上述分析知,反应Ⅲ平衡常数随温度升高减小,平衡逆向进行,错误;D、反应Ⅱ、Ⅲ的平衡常数随温度升高减小,说明正反应为放热反应,正确。
考点:考查化学平衡常数的概念及外界条件对化学平衡常数、化学平衡的影响。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
PH3是一种无色剧毒气体,其分子结构和NH3相似。下列判断错误的是( )
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3分子中所有原子最外层都满足8e—结构
D.PH3分子稳定性低于NH3分子,因为N-H键键长更短、键能更高
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
萨罗(Salo1)是一种消毒剂,属于芳香族含氧衍生物,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。则下列说法不正确的是:
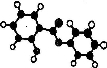
A.萨罗的分子式为Cl3Hl0O3
B.1mol萨罗与浓溴水反应,需要消耗3mol Br2
C.1mol萨罗发生水解,需要消耗3mol NaOH
D.萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:简答题
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp=x ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
下列物质的水溶液因发生水解而显酸性的是
A.NH4Cl B.KHSO4 C.NaHCO3 D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.在反应中消耗1mol Cl2,转移的电子数一定为2NA。
B.标准状况下,0.5mol氦气含有的电子数为NA
C.15g CH3+(碳正离子)中含有电子数为10NA
D.0.1L 2mol·L﹣1的(NH4)2S溶液中含有的S2﹣数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市万州区高三考前模拟理综化学化学试卷(解析版) 题型:选择题
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.B、D在周期表中的相对位置关系如图.下列说法正确的是

A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子构型均为直线型
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:实验题
(16分)(原创)硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
已知:Na2S2O3在酸性溶液中不能稳定存在。

(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,则试剂甲为:
。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、
。(用离子方程式表示)
②装置B、D的作用是 。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为: →g,h→ , → , →d。

(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程
式为: 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA
B. Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4 NA
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
D. 0.5 mol·L-1CuCl2溶液中含有Cu2+数小于0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com