
 Mg2+(aq)+2OH-(aq),若往该溶液中加入NaOH溶液,使溶液中的c(OH-)变为原来的10倍,则c(Mg2+)?[c(OH-)]2会变为原来的100倍,则Mg(OH)2在此溶液中的溶解度在理论上将变为原来的10-2倍,故答案为:10-2.
Mg2+(aq)+2OH-(aq),若往该溶液中加入NaOH溶液,使溶液中的c(OH-)变为原来的10倍,则c(Mg2+)?[c(OH-)]2会变为原来的100倍,则Mg(OH)2在此溶液中的溶解度在理论上将变为原来的10-2倍,故答案为:10-2.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3?H2O
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是白色金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2白色固体,难溶于水,可溶于强碱及NH3?H2O; ④Zn2+易形成络合物如[Zn(NH3)4] 2+,该络合物遇强酸分解生成Zn2+、NH4+。 |
●提出假设:
(1)假设1:该混合金属粉末中除镁外还含有 元素
(2)假设2:该混合金属粉末中除镁外还含有 元素
假设3:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
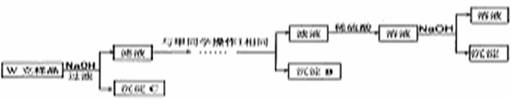
甲同学基于假设3设计实验方案如下:
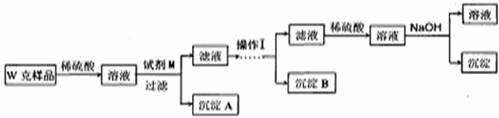
乙同学同样基于假设3设计另一实验方案如下:
(3)试剂M是
(4)写出操作I的过程
(5)丙同学认为乙同学的方案比甲同学的好,理由是
(6)丁同学研究了甲、乙两同学的方案后,用最简便的方法测定了Wg样品中金属镁(Mg)的质量分数,他的方法是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com