
【题目】胡椒酚是植物挥发油的成分之一,它的结构简式是![]() ,下列叙述中不正确的是 ( )
,下列叙述中不正确的是 ( )
A.1 mol胡椒酚最多可与4 mol H2发生反应
B.1 mol胡椒酚最多可与4 mol Br2发生反应
C.胡椒酚可与NaOH溶液反应
D.胡椒酚在水中的溶解度不大
科目:高中化学 来源: 题型:
【题目】几种中学化学中常见的单质及其化合物相互转化的关系图如下:
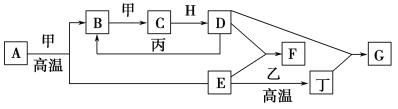
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为________,每消耗1 mol A转移的电子为______ mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:__________________________________________________________________;
(3)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
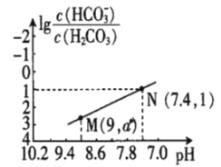
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯甲醛(CCl3CHO)可用于生产氯霉素、合霉素等,其在实验室制备的反应原理为C2H5OH+4C12![]() CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl
CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl ![]() C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
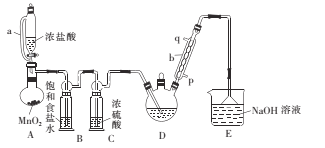
(1)仪器a的名称是____ ,采用该仪器的理由是____
(2)仪器b中冷凝水从___ (填“p”或“q”)口进。
(3)装置A中MnO2用KClO3代替,反应在常温下进行,试写出反应的离子方程式:____。若撤去装置B,对实验的影响是_______ 。
(4)测定产品纯度:
①称取0. 40 g产品,配成待测溶液,加入20. 00 mL0.100 mol/L碘标准溶液,再加适量碱液,充分反应:![]()
②再加适量盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定到终点,发生反应:I2+![]() ;
;
③重复上述操作3次,平均消耗Na2S2O3溶液20. 00 mL。
滴定时所用指示剂是____,达到滴定终点的现象是 ___,测得产品的纯度是____(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据烯烃、炔烃的命名原则,回答下列问题:
① 的名称是_____________________。
的名称是_____________________。
②![]() 的名称是_____________________。
的名称是_____________________。
③写出2甲基2戊烯的结构简式__________________。
④某烯烃的错误命名是2-甲基-4-乙基-2-戊烯,那么它的正确命名应是_____________________。
(2)有两种烃,甲为![]() ,乙为
,乙为![]() 。下列有关它们命名的说法正确的是____。
。下列有关它们命名的说法正确的是____。
A.甲、乙的主链碳原子数都是6个
B.甲、乙的主链碳原子数都是5个
C.甲的名称为2丙基1丁烯
D.乙的名称为3甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________,N、O、S元素的原子对键合电子吸引力最大的是___________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN中含有的π键的数目为__________。与CN互为等电子体的离子或分子有__________(写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________(填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为___________g/cm3。
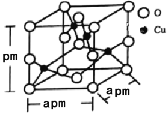
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
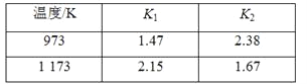
【题目】已知:反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1的平衡常数为K1;
反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2的平衡常数为K2。
反应③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3的平衡常数为K3。
不同温度时K1、K2的值如下表,下列说法正确的是 ( )
A.K3=K1-K2
B.K3=K1+K2
C.ΔH3>0
D.ΔH3<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)写出下列元素的名称 X_______,Y________,Z__________
(2)X—H键和Y—H键属于极性共价键,其中极性较强的是________(X、Y用元素符号表示)键。X的第一电离能比Y的________(填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:________________。
(4)W的基态原子的价电子排布式为____________;
(5)Y元素的核外电子轨道表示式为___________。
(6)已知一种Y4分子结构如图所示:

断裂1 mol Y—Y键吸收167 kJ的热量,生成1 mol Y≡Y放出942 kJ热量。则由1molY4气态分子变成2molY2气态分子_______(填写吸收或放出)_______kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com