
分析 (1)反应中Fe(OH)3→Na2FeO4,Fe元素化合价由+3价升高为+6价,总共升高3价,NaClO→NaCl,Cl元素的化合价由+1价降低为-1价,总降低2价,化合价升降最小公倍数为6,故系数为,故Fe(OH)3系数为2,故NaClO系数为3,由Fe元素守恒故Na2FeO4系数为3,由Cl元素守恒NaCl系数为3,由Na元素守恒NaOH系数为4,由H元素守恒H2O系数为5;
(2)该反应中氧化剂是次氯酸钠,铁元素化合价升高,被氧化;
(3)反应有2molNa2FeO4生成,转移6mol的电子.
解答 解:(1)反应中Fe(OH)3→Na2FeO4,Fe元素化合价由+3价升高为+6价,总共升高3价,NaClO→NaCl,Cl元素的化合价由+1价降低为-1价,总降低2价,化合价升降最小公倍数为6,故系数为,故Fe(OH)3系数为2,故NaClO系数为3,由Fe元素守恒故Na2FeO4系数为3,由Cl元素守恒NaCl系数为3,由Na元素守恒NaOH系数为4,由H元素守恒H2O系数为5,配平后方程式为:2Fe(OH)3+4 NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O,所以电子转移的方向与数目为: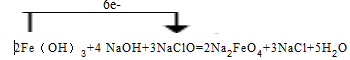 ,故答案为:
,故答案为: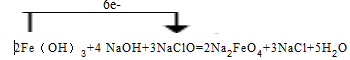 ;
;
(2)该反应中氧化剂是次氯酸钠,铁元素化合价升高,被氧化,故答案为:次氯酸钠;铁;
(3)反应有2molNa2FeO4生成,转移6mol的电子,故答案为:2molNa2FeO4;6.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,注意制备原理及物质的性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | “瓦斯”的主要成分为一氧化碳 | B. | 爆炸过程放出大量热量 | ||
| C. | 爆炸过程有氧气参与反应 | D. | 爆炸过程吸收大量热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②④ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA | |
| B. | 常温常压下,16gCH4所含中子数目为8NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 | |
| 分类标准 | 碱 | 常温下为固体 | 金属单质 | 酸 |
| 不属于该类别的物质 | SO2 | Cl2 | H2 | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气、硫酸铜、硫酸 | B. | 乙酸、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、蔗糖水、氢氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com