
| A、从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低 |
| B、由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高 |
| C、合成氨工业的反应温度控制在400~500℃左右,是因为该条件下氨的产率最高 |
| D、合成氨工业采用10 MPa~30MPa,是因该条件下催化剂的活性最好 |


科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 |
| 平衡常数 | 9.94 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性氧化物均可跟碱起反应 |
| B、酸性氧化物在常温常压下均为气态 |
| C、金属氧化物都是碱性氧化物 |
| D、不能跟酸反应的氧化物一定能跟碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a1=a2,且混合溶液的pH<7,则b1>b2 |
| B、若混合溶液的pH<7,则a1b1=a2b2 |
| C、若混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| D、若a1=a2,b1=b2,则混合溶液中c(CH3COO-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
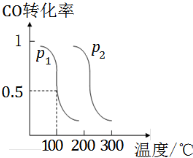
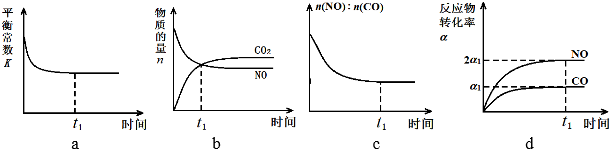
查看答案和解析>>
科目:高中化学 来源: 题型:
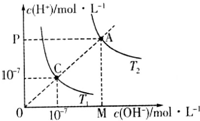
| A、水的离子积常数关系为:C>A |
| B、升高温度可实现由C点到A点 |
| C、T1时,pH=4的硫酸与pH=l0的氢氧化钠溶液等体积混合,所得溶液的pH=7 |
| D、图中矩形OMAP的面积表示T2时水的离子积的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
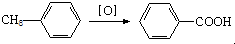 ;
;| CaO |
| △ |
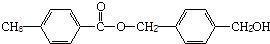 ,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工分子水平的标志.
,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工分子水平的标志.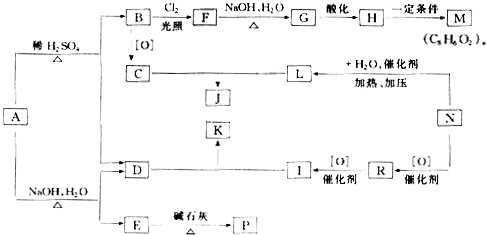
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容摇匀后发现液面低于刻度线,再加水至刻度线 |
| B、容量瓶中原来含有少量蒸馏水 |
| C、未洗涤烧杯和玻璃棒 |
| D、定容时俯视刻度线观察液面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com