
【题目】下列过程,观察不到颜色变化的是( )
A.HCl气体通入滴有酚酞的水溶液
B.往NaOH溶液中滴入FeCl3溶液
C.NH3气通过湿润的红色石蕊试纸
D.往AgNO3溶液中加入KCl溶液
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2) “酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 任何晶体中,若含有阳离子也一定含有阴离子
B. 分子晶体中只存在分子间作用力,不含有其他化学键
C. 离子晶体中只含有离子键,不含有共价键
D. 原子晶体中只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过査阅资料找到一种废钒催化剂的回收工艺流程路线如下:

可答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则V2O5转化为VO2+ 的离子方程式为______________。 “废渣1”的主要成分是_______。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式_______________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有_____________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉淀的化学方程式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空
(1)Mg2+的结构示意图________,O原子的电子式__________,NH3的结构式 _________。
(2)MgO 的电子式____________,Mg(NO3)2的式量是 _____________。
(3)约含有3.01×1022个NO分子的质量为_____g,在标准状态下所占的体积约为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满NO2的试管是( )。
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝有多重优良性能,因而有极为广泛的用途。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3,等杂质)为原料制备铝的一种工艺流程如图所示

下列说法不正确的是
A. “电解Ⅰ”的电解过程中作阳极的石墨易消耗
B. “电解Ⅱ”阴极区溶液pH变大
C. 理论上每生成1molAl,会有0.75molO2产生
D. “电解Ⅱ”阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
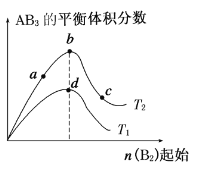
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com