
下列叙述正确的是
A.用乙醇或CCl4均可萃取碘水中的碘单质
B.CO2和SiO2晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做 法并无不妥,甚至可以说并不是害人而是救人.那么,这种做法的化学原理是
法并无不妥,甚至可以说并不是害人而是救人.那么,这种做法的化学原理是
A.胶体的电泳 B.血液的氧化还原反应
C.血液中发生复分解反应 D.胶体的聚沉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
三个密闭容器中分别充入H2、O2、CO2三种气体,以下各种情况下排序正确的是( )
A.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(O2)>m(CO2)
B.当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(02)>ρ(C02)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(CO2)>V(O2)>V(H2)
D.当它们的温度和密度都相同时,三种气体的压强:P(H2)>P(O2)>P(CO2)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
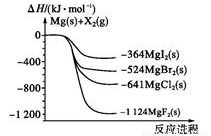
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2<MgBr2<MgCl2<MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:
MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为16。Y的原子半径比X 的大,X与W同主族,Z是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径的大小顺序: r(W)>r(Z)>r(Y)
B. 元素X、Y只能形成一种化合物
C. 元素W的简单气态氢化物的热稳定性比X的强
D. Y、W最高价氧化物所对应的水化物均能溶解Z的氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
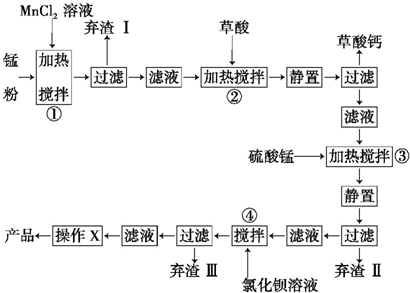
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
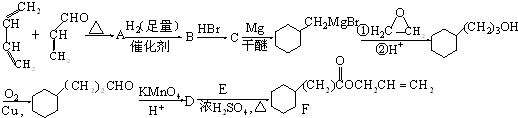
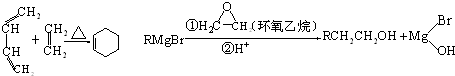
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 | |
| C. | A、B、C形成的化合物一定不能发生水解 | |
| D. | E的氧化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。
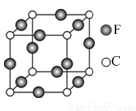
(5)C、E两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com