
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅱ中反应的平衡常数相同 |
| C、容器Ⅰ中CO的物质的量比容器Ⅱ中的少 |
| D、容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率和小于1 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 ):又当苯环上连卤原子时,高温高压下可以水解.
):又当苯环上连卤原子时,高温高压下可以水解.| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |



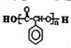 的合成路线流程图(无机试剂任选,限用4步完成).合成路线流程图如图:
的合成路线流程图(无机试剂任选,限用4步完成).合成路线流程图如图: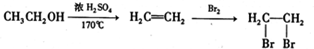
查看答案和解析>>
科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
| A、若丙为CO2,则甲可以是焦炭 |
| B、若丁为O2,则甲可以是N2 |
| C、若丁为Fe,则甲可以是Cl2 |
| D、若丁为CO2,则甲可以是NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Ag+、Na+、Ba2+、Fe2+、Al3+ |
| 阴离子 | Cl-、OH-、AlO2-、NO3-、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H5OH在电池的负极上发生氧化反应 |
| B、1mol乙醇被氧化转移6 mol电子 |
| C、在外电路中电子由负极沿导线流向正极 |
| D、电池正极的电极反应为4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、阳极的电极反应式是N2+6H++6e-═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实际产量 |
| 理论产量 |
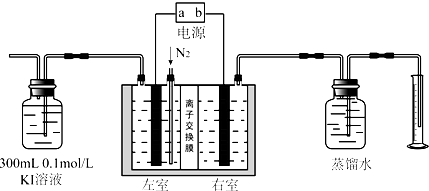
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com