
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |
分析 原子序数依次递增的四种短周期元素可形成简单离子X2-、Y+、Z3+、M2-,可知X为O,Y为Na、Z为Al、M为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:由上述分析可知,X为O,Y为Na、Z为Al、M为S,
A.Al为活泼金属,电解氧化铝可冶炼Al,故A正确;
B.非金属性O>S,则气态氢化物的稳定性:H2X>H2M,故B正确;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径由大到小:M2->X2->Y+>Z3+,故C错误;
D.X、Y形成的化合物为Na2O或Na2O2,阳离子、阴离子个数比一定是2:1,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、离子的电荷数来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
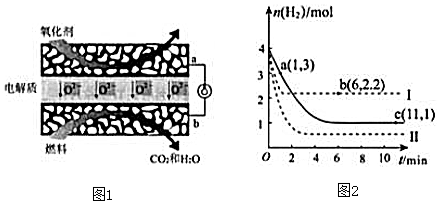
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
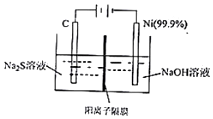 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:| 分子 | COS | H2 | H2O | CO | H2S | CO2 |
| 能量/KJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 电解由Y、Z组成的化合物可获得Z的单质 | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 由X、Y组成的化合物只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电极材料 Fe、Cu,电解质溶液 FeCl3 溶液 | |
| B. | 电极材料石墨、Cu,电解质溶液 Fe2(SO4)3溶液 | |
| C. | 电极材料 Pt、Cu,电解质溶液 FeCl3溶液 | |
| D. | 电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
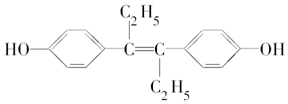
| A. | 可以使溴水褪色 | |
| B. | 该物质能发生氧化反应 | |
| C. | 1 mol该有机物可以与5 mol Br2发生反应 | |
| D. | 可与NaOH和NaHCO3溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:W>X | |
| C. | 单质熔点:X>W>Y | |
| D. | q与p、r的化学键种类完全不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com