
| A. |  2-乙基丙烷 | B. | CH3CH2CH2OH 1-丁醇 | ||
| C. |  2-氯-2-甲基丙烷 | D. |  2-甲基-2-丙烯 |
分析 A、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上的碳原子编号;
B、醇在命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子编号;
C、卤代烃命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子编号;
D、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子编号,并表示出双键的位置;
解答 解:A、烷烃命名时,要选最长的碳链为主链,故主链上有4个碳原子,从离支链近的一端给主链上的碳原子编号,故在2号碳原子上有一个甲基,故名称为:2-甲基丁烷,故A错误;
B、醇在命名时,要选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团近的一端给主链上的碳原子编号,故名称为1-丙醇,故B错误;
C、卤代烃命名时,要选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团近的一端给主链上的碳原子编号,故在2号碳原子上有一个甲基和一个氯原子,故名称为2-氯-2-甲基丙烷,故C正确;
D、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团近的一端给主链上的碳原子编号,并表示出双键的位置,故名称为:2-甲基-1-丙烯,故D错误;
故选C.
点评 本题考查了有机物的命名,应注意的是含官能团的有机物在命名时,要以官能团为考虑的对象来选主链和编号.


科目:高中化学 来源: 题型:解答题
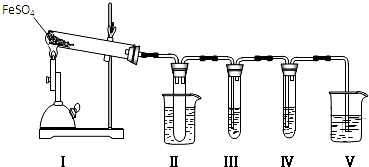
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5mol.L-1BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水). |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐 | |
| B. | BrCl具有较强的氧化性 | |
| C. | 能使润湿的淀粉碘化钾试纸变蓝 | |
| D. | BrCl与水反应中,BrCl既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH${\;}_{4}^{+}$=Mg2++2NH3•H2O | |
| B. | 磷酸一氢钠溶液水解:HPO${\;}_{4}^{2-}$+H2O?PO${\;}_{4}^{3-}$+H3O+ | |
| C. | 电解AlCl3溶液:2Al${\;}_{3}^{+}$+6Cl-+6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑+3Cl2↑ | |
| D. | 铜片接电正极,碳棒接电负极,电解硫酸溶液:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
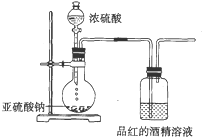 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑧ | B. | ②④⑥⑦⑨ | C. | ①③⑤⑥⑦ | D. | ①②④⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com