
| A. | 0.01mol/L盐酸 | B. | 0.01mol/L Na2CO3溶液 | ||
| C. | pH=4NaHSO3溶液 | D. | pH=11氨水 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
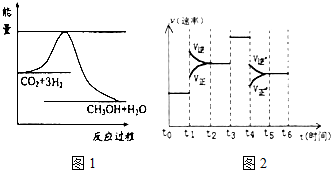 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿:Fe3O4 | B. | 铜绿:Cu2(OH)2CO3 | C. | 磁铁矿:Fe2O3 | D. | 明矾:2KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ•mol-1,则2molH2(g)和1molO2(g)所含有的总能量比2molH2O(l)所含有的总能量少483.6kJ | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 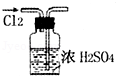 干燥Cl2 | |
| B. | 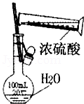 配制90ml 0.1mol•L-1硫酸溶液 | |
| C. | 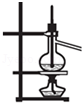 分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),120s时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com