
 已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热或点燃条件 | |
| B. | 该反应若生成2molAB2(g)则放出的热量为 (E1-E2) kJ | |
| C. | 该反应断开化学键消耗的总能量大于形成化学键释放的总能量 | |
| D. | 生成2 mol B-A键放出E2 kJ能量 |
分析 化学反应A2(g)+2B2(g)═2AB2(g)的能量变化依据图象分析,结合反应前后能量守恒可知,反应物能量之和小于生成物的能量之和,反应是吸热反应,反应过程中断裂化学键需要吸收能量,形成化学键放出热量,据此分析.
A.有的吸热反应在常温下就能进行反应,无需加热或点燃条件;
B.该反应为吸热反应;
C.吸热反应断开化学键消耗的总能量大于形成化学键释放的总能量;
D.依据图象分析判断生成2 mol B-A键放出的能量为断1molA2和2molB2键能吸收的能量与生成2 mol B-A键放出的热量差.
解答 解:A.反应前后能量守恒可知,反应物能量之和小于生成物的能量之和,反应是吸热反应,吸热反应不一定都要加热或点燃条件,例如氢氧化钡和氯化铵在常温下就反应,故A错误;
B.该反应焓变=断裂化学键吸收热量-形成化学键所放出热量,所以焓变为△H=+(E1-E2)kJ/mol,从图示可知E1>E2,焓变为△H>0吸热,该反应若生成2molAB2(g)则吸收的热量为 (E1-E2) kJ,故B错误;
C.反应是吸热反应,依据能量守恒可知,即反应物的键能总和大于生成物的键能总和,断开化学键消耗的总能量大于形成化学键释放的总能量,故C正确;
D.依据图象分析判断1molA2和2molB2反应生成2molAB2,吸收(E1-E2)kJ热量,故D错误;
故选C.
点评 本题考查了反应热量变化的分析判断、图象分析反应前后的能量守恒应用,理顺化学键的断裂、形成与能量的关系是解答关键,题目难度中等,试题有利于培养学生的分析、理解能力及化学计算能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、CO2、NH3 | B. | Na2O、Na2O2、Na2S | C. | NaCl、HCl、H2O | D. | NaOH、CaCl2 CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 建筑中使用的铝合金门窗比钢门窗更耐腐蚀 | |
| B. | 窗帘上直接受阳光照射的一面布料容易褪色 | |
| C. | 肉放在冷冻箱中要比放在保鲜箱中存放的时间更长久 | |
| D. | 实验室用硫酸溶液与锌粒反应制取氢气,反应一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又重新增多起来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
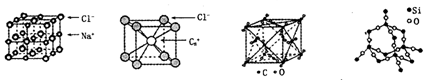
| A. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同 的晶体结构 | |
| B. | 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似物理 性质 | |
| C. | 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| D. | 二氧化硅晶体不是密堆积结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属原子最外电子层上都只有1个电子,容易失去 | |
| B. | 碱金属在常温下易被氧化 | |
| C. | 碱金属单质的密度小,熔点和沸点低 | |
| D. | 碱金属原子的核电荷数比较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com