
”¾ĢāÄæ”æøł¾ŻĻĀĮŠŹµŃé²Ł×÷ŗĶĻÖĻóĖłµĆµ½µÄ½įĀŪÕżČ·µÄŹĒ
Ń”Ļī | ŹµŃé²Ł×÷ĻÖĻó | ŹµŃé½įĀŪ |
A | Ļńij»ĘÉ«ČÜŅŗÖŠ¼ÓČėµķ·ŪKIČÜŅŗ,ČÜŅŗ³ŹĄ¶É« | ČÜŅŗÖŠŗ¬ÓŠBr2 |
B | ĻńijČÜŅŗÓėĻ”ŃĪĖį·“Ó¦²śÉśµÄĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ®,ŹÆ»ŅĖ®±ä»ė×Ē | øĆČÜŅŗÖŠŅ»¶Øŗ¬ÓŠCO32- |
C | ¼ÓČČŹ¢ÓŠÉŁĮæNH4HCO3 ¹ĢĢåµÄŹŌ¹Ü,²¢ŌŚŹŌ¹ÜæŚ·ÅÖĆŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½,ŹÆČļŹŌÖ½±äĄ¶ | NH4HCO3³Ź¼īŠŌ |
D | Ļņ¾ĆÖƵÄNa2SO3 ČÜŅŗÖŠ¼ÓČė×ćĮæBaCl2ČÜŅŗ,³öĻÖ°×É«³Įµķ,ŌŁ¼ÓČė×ćĮæĻ”ŃĪĖį,³Įµķ²æ·ÖČܽā | Na2SO3 ²æ·Ö±»Ńõ»Æ |
A. AB. BC. CD. D
”¾“š°ø”æD
”¾½āĪö”æ
![]() Ņ²ÄÜ°ŃI-Ńõ»ÆĪŖµāµ„ÖŹ£¬ĖłŅŌČÜŅŗÖŠæÉÄÜÓŠ
Ņ²ÄÜ°ŃI-Ńõ»ÆĪŖµāµ„ÖŹ£¬ĖłŅŌČÜŅŗÖŠæÉÄÜÓŠ![]() £¬¹ŹA“ķĪó£»
£¬¹ŹA“ķĪó£»![]() ”¢
”¢![]() ¶¼ÄÜÓėŃĪĖį·“Ó¦·Å³ö¶žŃõ»ÆĢ¼£¬¹ŹB“ķĪó£»¼ÓČČĢ¼ĖįĒāļ§ČÜŅŗ·Å³ö°±Ęų£¬°±ĘųÄÜŹ¹ŹŖČóµÄŹÆČļŹŌÖ½±äĄ¶£¬²»ÄÜÖ¤Ć÷Ģ¼ĖįĒāÄĘČÜŅŗ³Ź¼īŠŌ£¬¹ŹC “ķĪó£»Ļņ¾ĆÖƵÄŃĒĮņĖįÄĘČÜŅŗÖŠ¼ÓČė×ćĮæµÄĀČ»Æ±µČÜŅŗ£¬³öĻÖ°×É«³Įµķ£¬ŌŁ¼ÓČėĻ”ŃĪĖį£¬³Įµķ²æ·ÖČܽā£¬ĖµĆ÷ÓŠĮņĖį±µ”¢ŃĒĮņĖį±µĮ½ÖÖ³ĮµķÉś³É£¬ŌČÜŅŗÖŠŃĒĮņĖįÄĘ²æ·Ö±»Ńõ»Æ£¬¹ŹDÕżČ·”£
¶¼ÄÜÓėŃĪĖį·“Ó¦·Å³ö¶žŃõ»ÆĢ¼£¬¹ŹB“ķĪó£»¼ÓČČĢ¼ĖįĒāļ§ČÜŅŗ·Å³ö°±Ęų£¬°±ĘųÄÜŹ¹ŹŖČóµÄŹÆČļŹŌÖ½±äĄ¶£¬²»ÄÜÖ¤Ć÷Ģ¼ĖįĒāÄĘČÜŅŗ³Ź¼īŠŌ£¬¹ŹC “ķĪó£»Ļņ¾ĆÖƵÄŃĒĮņĖįÄĘČÜŅŗÖŠ¼ÓČė×ćĮæµÄĀČ»Æ±µČÜŅŗ£¬³öĻÖ°×É«³Įµķ£¬ŌŁ¼ÓČėĻ”ŃĪĖį£¬³Įµķ²æ·ÖČܽā£¬ĖµĆ÷ÓŠĮņĖį±µ”¢ŃĒĮņĖį±µĮ½ÖÖ³ĮµķÉś³É£¬ŌČÜŅŗÖŠŃĒĮņĖįÄĘ²æ·Ö±»Ńõ»Æ£¬¹ŹDÕżČ·”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫ĘųĢåA”¢BÖĆÓŚ¹Ģ¶ØČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£ŗ3A(g)£«B(g)2C(g)£«2D(g)£¬·“Ó¦½ųŠŠµ½10 sÄ©£¬“ļµ½Ę½ŗā£¬²āµĆAµÄĪļÖŹµÄĮæĪŖ1.8 mol£¬BµÄĪļÖŹµÄĮæĪŖ0.6 mol£¬CµÄĪļÖŹµÄĮæĪŖ0.8 mol”£
(1)ÓĆC±ķŹ¾10 sÄŚ·“Ó¦µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ______”£
(2)·“Ó¦Ē°AµÄĪļÖŹµÄĮæÅØ¶ČŹĒ_______”£
(3)10 sÄ©£¬Éś³ÉĪļDµÄÅضČĪŖ______”£
(4)AÓėBµÄĘ½ŗā×Ŗ»ÆĀŹÖ®±ČĪŖ_______”£
(5)Ę½ŗāŗó£¬ČōøıäĻĀĮŠĢõ¼ž£¬Éś³ÉDµÄĖŁĀŹČēŗĪ±ä»Æ(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)£ŗ
¢Ł½µµĶĪĀ¶Č____£»
¢ŚŌö“óŃ¹Ēæ____
¢ŪŌö“óAµÄÅضČ_____£»
¢ÜŗćČŻĻĀ³äČėNe______”£
(6)ĻĀĮŠŠšŹöÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ(Ģī±źŗÅ)_____£»
A.v(B)=2v(C)
B.ČŻĘ÷ÄŚŃ¹Ēæ²»ŌŁ·¢Éś±ä»Æ
C.AµÄĢå»ż·ÖŹż²»ŌŁ·¢Éś±ä»Æ
D.Ę÷ÄŚĘųĢåĆÜ¶Č²»ŌŁ·¢Éś±ä»Æ
E.ĻąĶ¬Ź±¼äÄŚĻūŗÄn molµÄBµÄĶ¬Ź±Éś³É2n molµÄD
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ½¾æMg(OH)2µÄČܽāĘ½ŗāŹ±£¬ĄūÓĆĻĀ±ķČżÖÖŹŌ¼Į½ųŠŠŹŌŃ飬ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ
±ąŗÅ | ¢Ł | ¢Ś | ¢Ū |
·ÖÉ¢ÖŹ | Mg(OH)2 | HCl | NH4Cl |
±ø×¢ | Šü×ĒŅŗ | 1 mol/L | 1 mol/L |
A. Ļņ¢ŁÖŠµĪČė¼øµĪ·ÓĢŖŹŌŅŗŗó£¬ČÜŅŗĻŌŗģÉ«ĖµĆ÷Mg(OH)2ŹĒŅ»ÖÖČõµē½āÖŹ
B. ĪŖĮĖŹ¹Mg(OH)2Šü×ĒŅŗČܽāµĆøüæģ£¬¼ÓČė¹żĮæµÄNH4ClÅØČÜŅŗ²¢³ä·ÖÕńµ“£¬Š§¹ūøüŗĆ
C. ¢Ł”¢¢Ū»ģŗĻŗó·¢Éś·“Ó¦£ŗMg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3”¤H2O(aq)
Mg2+(aq)+2NH3”¤H2O(aq)
D. Ļņ¢ŁÖŠ¼ÓČė¢Ś£¬H+ÓėOH”Ŗ·“Ӧɜ³ÉH2O£¬Ź¹c(OH£)¼õŠ”£¬Mg(OH)2ČܽāĘ½ŗāĻņČܽā·½ĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
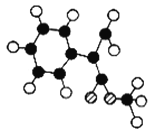
”¾ĢāÄæ”æČā¹šĖį¼×õ„M³£ÓĆ×÷µ÷ÖĘ¾ßÓŠ²ŻŻ®”¢ĘĻĢŃ”¢Ó£ĢŅµČĻćĪ¶µÄŹ³ÓĆĻć¾«”£MŹōÓŚ·¼Ļć»ÆŗĻĪļ£¬±½»·ÉĻÖ»ŗ¬Ņ»øöÖ±Ö§Į“£¬ÄÜ·¢Éś¼Ó¾Ū·“Ó¦ŗĶĖ®½ā·“Ó¦”£²āµĆMµÄĦ¶ūÖŹĮæĪŖ162 g”¤mol£1£¬Ö»ŗ¬Ģ¼”¢Ēā”¢ŃõČżÖÖŌŖĖŲ£¬ĒŅŌ×ÓøöŹżÖ®±ČĪŖ5”Ć5”Ć1”£
£Ø1£©Čā¹šĖį¼×õ„µÄ½į¹¹¼ņŹ½ŹĒ___________________________”£
£Ø2£©GĪŖČā¹šĖį¼×õ„µÄŅ»ÖÖĶ¬·ÖŅģ¹¹Ģ壬Ęä·Ö×Ó½į¹¹Ä£ŠĶČēĶ¼ĖłŹ¾£ØĶ¼ÖŠĒņÓėĒņÖ®¼äĮ¬Ļß±ķŹ¾µ„Į“»ņĖ«¼ü£©”£GµÄ½į¹¹¼ņŹ½ĪŖ_____________”£
£Ø3£©ŅŌ·¼ĻćĢžAĪŖŌĮĻŗĻ³ÉGµÄĀ·ĻßČēĻĀ£ŗ
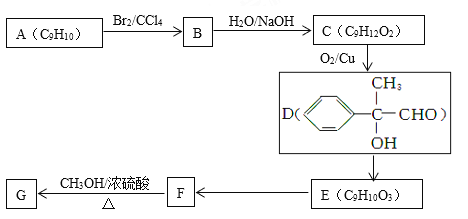
¢Ł»ÆŗĻĪļEÖŠµÄŗ¬Ńõ¹ŁÄÜĶÅÓŠ_____________(ĢīĆū³Ę)”£
¢ŚE”śFµÄ·“Ó¦ĄąŠĶŹĒ__________£¬F”śGµÄ»Æѧ·½³ĢŹ½ĪŖ______________________”£
¢Ū·ūŗĻĻĀĮŠĢõ¼žµÄFµÄĶ¬·ÖŅģ¹¹ĢåÖŠ£ŗ
¢ń£®·Ö×ÓÄŚŗ¬±½»·£¬ĒŅ±½»·ÉĻÖ»ÓŠŅ»øöÖ§Į“£»²»ŗ¬”°ØDOØDOØD”±ŗĶ”°ØDC”ŌCØD”±£»
¢ņ£®ŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬1 moløĆĪļÖŹÓė×ćĮæĒāĘų³ä·Ö·“Ó¦£¬ĻūŗÄ5 mol H2£»
¢ó£®Ėü²»ÄÜ·¢ÉśĖ®½ā·“Ó¦£¬²»ÄÜ·¢Éśõ„»Æ·“Ó¦”£
ĘäÖŠÄÜÓėŅų°±ČÜŅŗ·“Ó¦£¬ĒŅ1moløĆÓŠ»śĪļÓėĪö³öµÄŅųµÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć4µÄŹĒ_________________________________(Š“½į¹¹¼ņŹ½)£»ĘäÖŠŗĖ“Ź²ÕńĒāĘ×Ķ¼ÖŠÓŠ6øö·å£¬ĒŅ·åĆ껿֮±ČĪŖ1”Ć1”Ć1”Ć1”Ć2”Ć2µÄŹĒ _________________________(Š“½į¹¹¼ņŹ½)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ»Æѧ·“Ó¦A2 (g)+B2 (g)=2AB (g)µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
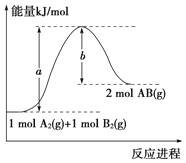
A. øĆ·“Ó¦ĆæÉś³É2·Ö×ÓABĪüŹÕ(a-b)kJÄÜĮæ
B. øĆ·“Ó¦ÖŠ·“Ó¦ĪļµÄ×ÜÄÜĮæøßÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ
C. øĆ·“Ó¦µÄ·“Ó¦ČȦ¤H=+(a-b) kJ”¤mol-1
D. ¶ĻĮŃ1molA-A¼üŗĶ1molB-B¼ü£¬·Å³öakJÄÜĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»øöČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė0.8 molµÄA2ĘųĢåŗĶ0.6 mol B2ĘųĢ壬Ņ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗA2(g)£«B2(g)![]() 2AB(g)””¦¤H<0£¬·“Ó¦ÖŠø÷ĪļÖŹµÄÅضČĖꏱ¼äµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
2AB(g)””¦¤H<0£¬·“Ó¦ÖŠø÷ĪļÖŹµÄÅضČĖꏱ¼äµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ

A. Ķ¼ÖŠaµćµÄÖµĪŖ0.15 B. øĆ·“Ó¦µÄĘ½ŗā³£ŹżK£½0.03
C. ĪĀ¶ČÉżøߣ¬Ę½ŗā³£ŹżKÖµ¼õŠ” D. Ę½ŗāŹ±A2µÄ×Ŗ»ÆĀŹĪŖ62.5%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČŹ±£¬Ag2SO4ŌŚĖ®ČÜŅŗÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ

A. bµć¶ŌÓ¦µÄKspµČÓŚcµć¶ŌÓ¦µÄKsp
B. ²ÉČ”Õō·¢ČܼĮµÄ·½·ØæÉŅŌŹ¹ČÜŅŗ“Óaµć±äµ½bµć
C. øĆĪĀ¶ČĻĀ£¬Ag2SO4µÄKsp£½1.6”Į10£5
D. 0.02 mol”¤L£1µÄAgNO3ČÜŅŗÓė0.2 mol”¤L£1µÄNa2SO4ČÜŅŗµČĢå»ż»ģŗĻ²»»įÉś³É³Įµķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³ŃŠ¾æŠŌѧĻ°Š”×éĪŖĮĖĢ½¾æ“×ĖįµÄµēĄėĒéæö,½ųŠŠĮĖČēĻĀŹµŃ锣ÓĆpH¼Ę²ā¶Ø25 ”ꏱ²»Ķ¬ÅØ¶ČµÄ“×ĖįµÄpH£¬Ęä½į¹ūČēĻĀ£ŗ
“×ĖįÅضČ/mol”¤L£1 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
£Ø1£©Š“³ö“×ĖįµÄµēĄė·½³ĢŹ½£ŗ__________________________”£
£Ø2£©øł¾Ż±ķÖŠŹż¾Ż£¬æÉŅŌµĆ³ö“×ĖįŹĒČõµē½āÖŹµÄ½įĀŪ£¬ÄćČĻĪŖµĆ³ö“Ė½įĀŪµÄŅĄ¾ŻŹĒ__________________”£
£Ø3£©Ļņ“×ĖįČÜŅŗÖŠ¼ÓČėŅ»¶ØĮæµÄNaOHČÜŅŗ£¬µ±²āµĆČÜŅŗµÄpH=7Ź±£¬ČÜŅŗÖŠĄė×ÓµÄÅØ¶Č“óŠ”ĪŖ____
£Ø4£©25”ę£¬½«0.1mol/LµÄCH3COOHČÜŅŗŗĶ0.1mol/LµÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗóČÜŅŗµÄpH=10£¬ŌņøĆ»ģŗĻČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(OH-)=___________mol/L£¬Š“³öøĆ»ģŗĻČÜŅŗÖŠĻĀĮŠĖćŹ½µÄ¾«Č·½į¹ū(²»ÄÜ×ö½üĖĘ¼ĘĖć)£¬c(Na£«)£c(CH3COO£)£½______________mol/L”£
£Ø5£©ĻĀĮŠ·½·ØÖŠ£¬æÉŅŌŹ¹0.10 mol”¤L£1 CH3COOHµÄµēĄė³Ģ¶ČŌö“óµÄŹĒ___________
a£®¼ÓČėÉŁĮæ0.10 mol”¤L£1µÄĻ”ŃĪĖį b£®¼ÓČČCH3COOHČÜŅŗ
c£®¼ÓĖ®Ļ”ŹĶÖĮ0.010 mol”¤L£1 d£®¼ÓČėÉŁĮæ±ł“×Ėį
e£®¼ÓČėÉŁĮæĆ¾·Ū f£®¼ÓČėÉŁĮæ0.10 mol”¤L£1µÄNaOHČÜŅŗ
£Ø6£©ŹŅĪĀŹ±“×ĖįµÄµēĄė³£ŹżKa=1.8”Į10-5 £¬ŌņCH3COO£µÄĖ®½ā³£ŹżKh= ____________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀķĄ“Ėįōū£ØĖ³-¶”Ļ©¶žĖįøĪ£©![]() ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬æÉÓĆÓŚŗĻ³Éæɽµ½āµÄøß¾ŪĪļPESŹ÷Ö¬ŅŌ¼°¾ßÓŠæ¹Ö×Įö»īŠŌµÄ»ÆŗĻĪļK”£
ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬æÉÓĆÓŚŗĻ³Éæɽµ½āµÄøß¾ŪĪļPESŹ÷Ö¬ŅŌ¼°¾ßÓŠæ¹Ö×Įö»īŠŌµÄ»ÆŗĻĪļK”£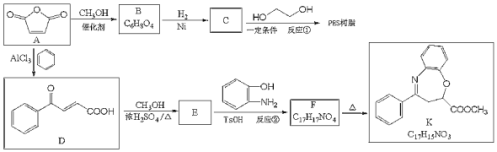
¼ŗÖŖ£ŗ
I£®![]() +
+![]()
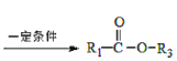 +
+![]()
II£®![]()
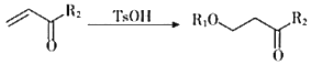
III£®![]()
 +H2O(
+H2O(![]() “ś±ķĢž»ł)
“ś±ķĢž»ł)
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©CµÄĆū³ĘŹĒ__________£¬·“Ó¦¢ŚµÄ·“Ó¦ĄąŠĶŹĒ_______
£ØQ£©BµÄĖ³Ź½½į¹¹¼ņŹ½ĪŖ_________£¬Fŗ¬Ńõ¹ŁÄÜĶŵĽį¹¹¼ņŹ½__________”£
£Ø3£©·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ_______________”£
£Ø4£©CÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÓėC¾ßÓŠĶźČ«ĻąĶ¬µÄ¹ŁÄÜĶÅ£¬ĒŅŗĖ“Ź²ÕńĒāĘ×Ö»ÓŠĮ½øö·åµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ĪŖ__________£Ø²»æ¼ĀĒĮ¢ĢåŅģ¹¹£©”£
£Ø5£©¼ŗÖŖ£ŗ°±»ł£Ø![]() £©ÓėōĒ»łĄąĖĘ£¬Ņ²ÄÜ·¢Éś·“Ó¦I”£ŌŚÓÉFÖʱøKµÄ¹ż³ĢÖŠ£¬³£»į²śÉśø±²śĪļL£¬L·Ö×ÓŹ½ĪŖ
£©ÓėōĒ»łĄąĖĘ£¬Ņ²ÄÜ·¢Éś·“Ó¦I”£ŌŚÓÉFÖʱøKµÄ¹ż³ĢÖŠ£¬³£»į²śÉśø±²śĪļL£¬L·Ö×ÓŹ½ĪŖ![]() £¬ŗ¬ČżøöĮłŌŖ»·£¬ŌņLµÄ½į¹¹¼ņŹ½ĪŖ________”£
£¬ŗ¬ČżøöĮłŌŖ»·£¬ŌņLµÄ½į¹¹¼ņŹ½ĪŖ________”£
£Ø6£©Š“³öÓÉBŗĻ³É¾ĘŹÆĖį £ØµÄŗĻ³ÉĀ·Ļߣŗ_______________________”£
£ØµÄŗĻ³ÉĀ·Ļߣŗ_______________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com