
| A、乙烯 乙醛 |
| B、乙炔 乙二醇 |
| C、甲烷 甲醇 |
| D、甲烷 乙醇 |
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |
| y |
| 4 |
| z |
| 2 |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
 用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )| 选项 | 电源X极 | 实验前U形管中液体 | 通电后现象及结论 |
| A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞试液后,a管中呈红色 |
| B | 正极 | AgNO3溶液 | b管中电极反应式是:4OH--4e-=2H2O+O2↑ |
| C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
| D | 负极 | 酒精 | b管中可能产生乙醛 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH和CH3CH2CH2OH |
| B、CH3CH2OH和CH3CH(OH)CH3 |
| C、CH3CH2OH和CH3(CH2)3CH2OH |
| D、CH3CH2CH2OH和CH3(CH2)3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18 | B、20 | C、22 | D、24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,| A、1.75 mol/L |
| B、3.5 mol/L |
| C、2.25 mol/L |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mo1?L-1的Na2CO3溶液中:c(OH-)═c(HCO3-)+c(H+)+c(H2CO3) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3->c(CO32-)>c(H2CO3) |
| D、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
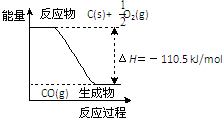 已知:①反应2C+O2=2CO 的能量变化如图所示.②含5.6g KOH的稀溶液与0.5L 0.1mol/L的H2SO4溶液反应放出5.73kJ的热量.下列说法正确的是( )
已知:①反应2C+O2=2CO 的能量变化如图所示.②含5.6g KOH的稀溶液与0.5L 0.1mol/L的H2SO4溶液反应放出5.73kJ的热量.下列说法正确的是( )| A、2mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |
| B、12g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ |
| C、该反应的热化学方程式是:2C(s)+O2(g)=2CO(g)△H=-110.5 kJ/mol |
| D、表示中和热的热化学方程式2KOH (aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (l)△H=-114.6 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com