
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式 。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是 溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为 。
(4)可用如图实验装置精制粗溴。
①图中冷却水应从B的 口进入(填“a”或“b”) 。
②C中加冰的目的是降温,减少溴的 。
(1)Br2+SO2+2H2O=4H++2Br-+SO42-(2)富集 (3)分液漏斗 (4)①b ②挥发
解析试题分析:(1)单质溴具有氧化性,SO2具有还原性,所以步骤3中的反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-。
(2)由于步骤2中得到的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴,因此还要进行步骤3和步骤4的原因是富集溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为分液漏斗。
(4)①由于逆向冷却的效果好,所以冷却水应从B的b口进入。
②单质溴易挥发,所以C中加冰的目的是降温,减少溴的挥发。
考点:考查海水中获得溴的实验方案设计与评价


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:实验题
某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.假设为:固体产物为MgO II.假设为:______________III.假设为:______________
请回答下列问题:资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O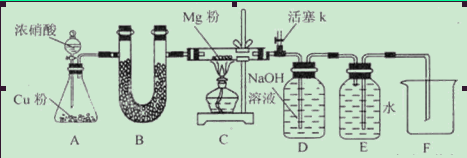
(1)如图连接好仪器,装药品前如何检验装置的气密性_____________________________
(2)装置B中盛装的干燥剂可以是(填序号)___________________
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是_________________________
(4)E中收集到的气体对氢气的相对密度是14,该气体是__________________
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设__________________成立。C中发生的化学反应方程式有_______________________________________________
(6)本实验中存在明显缺陷,改进措施是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应有
(填化学式)
(2)试剂Ⅰ、Ⅱ、Ⅲ的化学式分别为 、 、
(3)步骤①和②中,所用的玻璃仪器除胶头滴管,还应有
(4)步骤①中,判断试剂Ⅰ已加入过量的方法是:
(5)某同学根据最终所得KCl晶体和原样品的质量求算出氯化钾样品的纯度,你认为其结果是否可靠?并说明理 (不考虑实验误差):
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组将一定浓度的Na2CO3溶液滴入MgSO4溶液中得到白色沉淀。甲同学认为两者反应只生成MgCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Mg(OH)2一种沉淀;丙同学认为生成MgCO3和Mg(OH)2两种沉淀。(查阅资料知:MgCO3和Mg(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和MgSO4溶液反应的化学反应方程式为___________________;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明沉淀物中只有碳酸镁。
①各装置连接顺序为__________________(用装置编号表示);
②装置C中装有试剂的名称是______________;
③能证明生成物中只有MgCO3的实验现象是_______。
(3)若Mg(OH)2和MgCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
实验结束时通入过量的空气的作用是______________________________。
A装置和E装置的共同作用是__________________________。
③实验过程中测定的数据有:W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成水的质量,W4:反应生成二氧化碳的质量,为了测定其组成,至少需要其中____个数据,请将可能的组合填入下表中(每个空格中填一种组合)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
MnO2是一种重要的催化剂。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: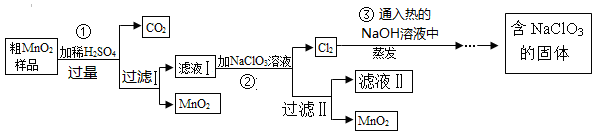
(1)写出1个用二氧化锰作催化剂的化学反应方程式 。
(2)第②步反应的离子反应方程式为 。
(3)检验过滤Ⅰ所得的MnO2是否洗涤干净的方法是 。
(4)第③步反应的化学反应方程式为 。
(5)上述流程中可用于循环使用的物质是 (填化学式);过滤操作和蒸发操作中都要用到的玻璃仪器是 。
(6)若粗MnO2样品的质量为25.38g,第①步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则样品中所含的MnO质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
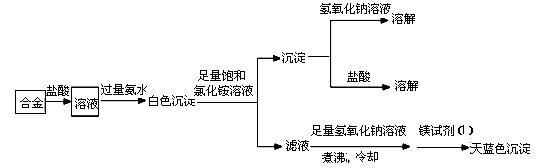
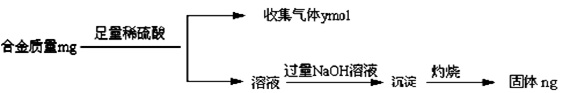
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
达州市渠县境内含有丰富的深层地下食盐资源,食盐是日常生活中的必需品,也是重要的化工原料。
(1)经测定该县深层地下粗盐中含有少量K+、Ca2+、Mg2+、Fe3+等杂质离子,某研究性学习小组在实验室提纯NaCl的流程如下:
所提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇溶液、CCl4,仪器及用品自选。
①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-,选出a操作中所代表的试剂,按滴加顺序依次为
(只填化学式),b步操作的名称是 。
②洗涤除去NaCl晶体表面附带的少量KCl,应选用试剂是 ,用PH试纸测定滤液ⅡPH值的方法是 。
(2)用提纯的NaCl配制500mL,2.5mol·L-1的NaCl溶液,所需仪器除烧杯,托盘天平(砝码和镊子),药匙,玻璃棒外,还需要 (填仪器名称),应称取NaCl g
(3)下列操作会导致所配NaCl溶液浓度偏高的是
| A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线。 | |
| B.未将洗涤烧杯内壁的溶液转入容量瓶。 | C.定容时,俯视刻度线。 |
| D.转移溶液之前,容量瓶内有少量蒸馏水。 E、称量时,天平指针指向左盘。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:
(1)CaCO3与盐酸反应的离子方程式 。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 ,若用氢氧化钠溶液除杂则产品中可能混有的物质为 。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是 。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④ ⑤ 等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL 0.5000 mol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为 。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由 引起的(填序号),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。
已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com