
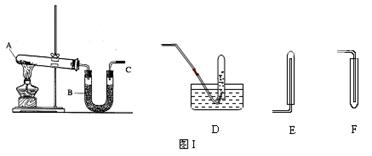
 2NH3 ↑+ 2H2O + CaCl2 (2)E(3)碱石灰(生石灰或固体氢氧化钠)
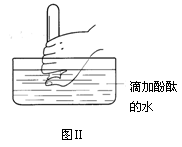
2NH3 ↑+ 2H2O + CaCl2 (2)E(3)碱石灰(生石灰或固体氢氧化钠) 2NH3 ↑+ 2H2O + CaCl2;(2)氨气极易溶于水,不能用排水法收集,氨气的密度比空气小,应用向下排空气法收集,为收集到干燥的氨气,导管C应接E;(3)装置B的作用是干燥氨气,盛装的试剂的名称是碱石灰(生石灰或固体氢氧化钠);(4)氨气极易溶于水,与水反应生成弱碱一水合氨;可观察到的现象为溶液进入试管中,无色溶液变红;(5)NO能与空气中的氧气反应,不能用排空气法收集,一氧化氮不溶于水,可用排水法收集,在D、E、F三种气体收集方法中,能用于收集NO的是D。
2NH3 ↑+ 2H2O + CaCl2;(2)氨气极易溶于水,不能用排水法收集,氨气的密度比空气小,应用向下排空气法收集,为收集到干燥的氨气,导管C应接E;(3)装置B的作用是干燥氨气,盛装的试剂的名称是碱石灰(生石灰或固体氢氧化钠);(4)氨气极易溶于水,与水反应生成弱碱一水合氨;可观察到的现象为溶液进入试管中,无色溶液变红;(5)NO能与空气中的氧气反应,不能用排空气法收集,一氧化氮不溶于水,可用排水法收集,在D、E、F三种气体收集方法中,能用于收集NO的是D。

科目:高中化学 来源:不详 题型:单选题
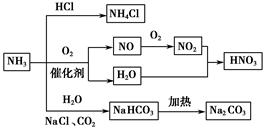
| A.NH4Cl和NaHCO3都是常用的化肥 |
| B.NH4Cl、HNO3和Na2CO3受热时都易分解 |
| C.NH3和NO2在一定条件下可发生氧化还原反应 |
| D.NH3合成NaHCO3的副产物的水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
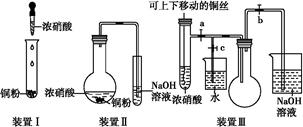
| A.颜色 |
| B.质量 |
| C.气体的平均相对分子质量 |
| D.密度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中一定无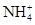 |
| B.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体 |
| C.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色 |
| D.46 g NO2和N2O4混合气体中含有原子总数为3NA,含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
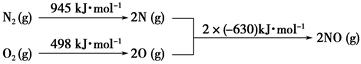
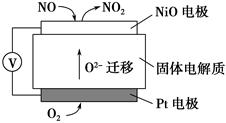
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| B.在KI-淀粉溶液中通入氯气,溶液变蓝,是因为生成的单质碘与淀粉发生显色反应 |
| C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含SO42- |
| D.实验室可用氯化铵与氢氧化钙加热制取氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
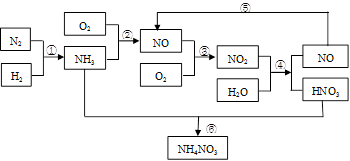
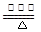 ____NO+ ________
____NO+ ________ 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
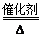 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)| | 注意事项 | 理由 |
| ① | ______________ | ____________ |
| ② | ________________ | ____________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.现象①中产生的红棕色气体为NO2 |
| B.产生现象②的原因是NO2与水反应 |
| C.产生现象③的原因是铜与稀硝酸反应 |
| D.最终瓶内溶液中的溶质一定只有Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com