
| A. | 灼热的炭与二氧化碳反应 | B. | 铁和稀硫酸的反应 | ||
| C. | 硝酸铵溶于水 | D. | 钢铁制品的生锈 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
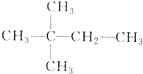 ,则A的结构简式为
,则A的结构简式为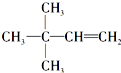 ;A加氢产物的一氯代物有3种.
;A加氢产物的一氯代物有3种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应物 | 化学方程式 | 反应类型 |
| ②和④ | ||
| 苯和③ | ||
| ⑥和① |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
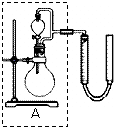 过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
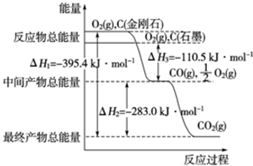 金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.
金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com