
(1)在进行沉淀反应的实验时,如何确定沉淀已经完全?
(2)中学化学实验中,怎样在过滤器中洗涤沉淀?
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
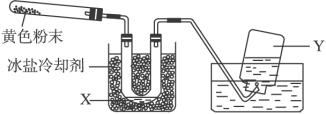
回答下面问题:
(1)在装置中试管和U形管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是_________________________________________。
(2)液体X可能是__________;气体Y可能是_____________。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意________________________,理由是________________________。
(4)用简单的实验证实(2)中的判断。
①对X的判断:_______________________________________。
②对Y的判断:_______________________________________。
(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
查看答案和解析>>
科目:高中化学 来源: 题型:
①称量a g样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解;
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液;
④过滤,用蒸馏水洗涤沉淀;
⑤加热干燥沉淀物;
⑥将沉淀物冷却至室温后,称量;
⑦重复⑤⑥操作直到合格,最后得到b g固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?________,其理由是________________。
(2)步骤③中加盐酸使溶液呈强酸性的目的是________________________。
(3)步骤⑦的“合格”标准是________________。
(4)实验测得样品中无水亚硫酸钠的质量分数是________ (列出算式,不需化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
请回答下面问题:
(1)甲同学想通过实验测得的数据是_________。他使用装置③_______(填“有”或“没有”)必要。
(2)乙同学想通过实验测得的数据是_________。按他测得的数据计算出的实验结果_________。(填“偏高”或“偏低”),理由是____________________________________________。
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序:___________________________。
(4)按你设计的实验装置进行实验,若测得实验前后装置②的质量分别是W1和W2,则样品中过碳酸钠的质量分数为_________。
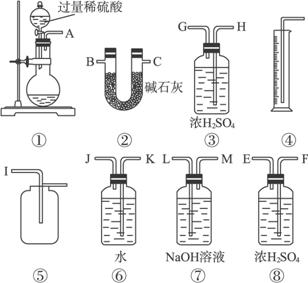
查看答案和解析>>
科目:高中化学 来源: 题型:
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_______ (用化学式表示)。下列能使醋酸
溶液中CH3COOH的电离程度增大,而电离常数不变的操作是_____ (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____ (选填“酸性”“中性”或“碱性”),理由是____________________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大
到小排列为____________________________。
(4)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | Cus | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-55 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。(选填序号)
①NaOH ②FeS ③Na2S
查看答案和解析>>
科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(三)试卷 题型:填空题
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
|
酸或碱 |
电离常数(Ka或Kb) |
|
CH3COOH |
1.8×10-5 |
|
HNO2 |
4.6×10-4 |
|
HCN |
5×10-10 |
|
HClO |
3×10-8 |
|
NH3·H2O |
1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_______ (用化学式表示)。下列能使醋酸
溶液中CH3COOH的电离程度增大,而电离常数不变的操作是_____ (填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____ (选填“酸性”“中性”或“碱性”),理由是____________________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大
到小排列为____________________________。
(4)已知一些难溶物的溶度积常数如下表:
|
物质 |
FeS |
MnS |
Cus |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-55 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们。(选填序号)
①NaOH ②FeS ③Na2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com