
| A. | H+(aq)+$\frac{1}{2}$SO42-(aq)+$\frac{1}{2}$Ba2+(aq)+OH-(aq)═$\frac{1}{2}$BaSO4(s)+H2O(1);△H=-57.3 kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l);△H=-57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$O2 (g)═8CO2 (g)+9H2O(g);△H=-5518 kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)═16CO2 (g)+18H2O(1);△H=-5518 kJ/mol |
分析 在101kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热;在稀溶液中,稀的酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热,据此分析判断.
解答 解:A、中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量为57.3kJ/mol;酸碱反应生成硫酸钡沉淀过程中伴随有沉淀生成热,反应焓变△H<-57.3kJ/mol,故A错误;
B、在稀溶液中,酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热,故B正确;
C、水的稳定的氧化物应是液态水而不是气态水,故C错误;
D、燃烧热概念要求必须是lmol物质完全燃烧,即C8H18(g)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(1)△H=-5518kJ/mol,故D错误.
故选B.
点评 本题主要考查学生对燃烧热和中和热的概念的理解和掌握以及热化学方程式的书写问题,难度不大.


科目:高中化学 来源: 题型:选择题
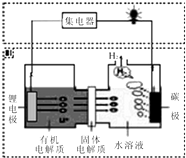 近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )| A. | 碳极发生的反应是:2H2O+2e-=H2↑+2OH - | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 标况下产生22.4L的氢气时,正极消耗锂的质量为14g | |
| D. | 该装置不仅可提供电能,还可得到清洁的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
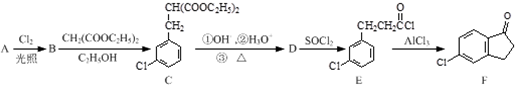
 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.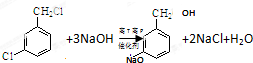 .
. 或
或 (任写一种).
(任写一种).
 .
.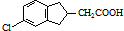 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: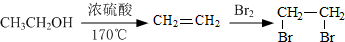
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 230Th和232Th是钍的两种同素异形体 | |
| B. | H2与T2互为同位素 | |
| C. | 甲醇与乙醇互为同系物 | |
| D. | 乙酸乙酯与丁酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 | |
| C. | 将该溶液蒸干,得到的固体中混有氢氧化铁 | |
| D. | 100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com