
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 苯的同系物 |
分析 A.烷烃的通式为CnH2n+2,碳元素的质量分数为$\frac{12n}{14n+2}$=$\frac{12}{14+\frac{2}{n}}$;
B.烯烃的通式为CnH2n,碳元素的质量分数为$\frac{12n}{14n}$;
C.炔烃的通式为CnH2n-2,碳元素的质量分数为$\frac{12n}{14n-2}$=$\frac{12}{14-\frac{2}{n}}$;
D.苯的同系物的通式为CnH2n-6,碳元素的质量分数为$\frac{12n}{14n-6}$=$\frac{12}{14-\frac{6}{n}}$.
解答 解:A.烷烃的通式为CnH2n+2,碳元素的质量分数为$\frac{12n}{14n+2}$=$\frac{12}{14+\frac{2}{n}}$,n越大,碳元素的质量分数也增大,故A选;
B.烯烃的通式为CnH2n,碳元素的质量分数为$\frac{12n}{14n}$,质量分数为定值,不随n的变化而变化,故B不选;
C.炔烃的通式为CnH2n-2,碳元素的质量分数为$\frac{12n}{14n-2}$=$\frac{12}{14-\frac{2}{n}}$,n越大,碳元素的质量分数越小,故C不选;
D.苯的同系物的通式为CnH2n-6,碳元素的质量分数为$\frac{12n}{14n-6}$=$\frac{12}{14-\frac{6}{n}}$,n越大,碳元素的质量分数越小,故D不选;
故选A.
点评 本题考查有机物中碳元素的质量分数,为高频考点,把握有机物的组成通式为解答的关键,侧重分析与计算能力的考查,注意计算式的变化,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Q、R的最高价氧化物对应水化物间可反应 | |
| B. | Y的简单氢化物比Z的简单氢化物稳定 | |
| C. | 可通过电解熔融氯化物的方法制备Q、R | |
| D. | X元素单质在化学反应中只表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图:
乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图: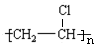
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中只含共价键 | |
| B. | 离子化合物中可能含有共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 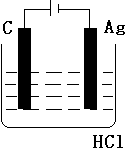 | B. | 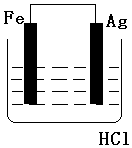 | C. | 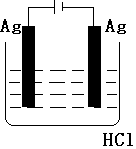 | D. | 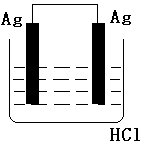 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
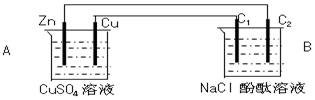
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 用铜电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2 Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应 | |
| B. | 等质量Na2CO3、NaHCO3分别与相同浓度的盐酸反应,NaHCO3消耗的盐酸体积少 | |
| C. | 向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 | |
| D. | 等物质的量Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com