
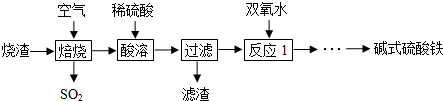
分析 硫酸厂烧渣焙烧时,FeS与氧气反应生成氧化铁与二氧化硫,再用硫酸酸浸,Fe的氧化物与硫酸反应得到盐,二氧化硅不反应,过滤得到滤渣为SiO2,滤液中加入过氧化氢,将溶液中Fe2+氧化为Fe3+,再结构系列转化得到碱式硫酸铁.
(1)二氧化硫与足量的氢氧化钠反应生成亚硫酸钠与水;
(2)滤渣为不与硫酸反应的二氧化硅;
(3)滤液中加入过氧化氢,将溶液中Fe2+氧化为Fe3+;
(4)步骤②中得到2.3300g固体为BaSO4沉淀,步骤③中得到0.6400g为氧化铁的质量,根据n=$\frac{m}{M}$计算二者物质的量,根据硫酸根守恒、Fe元素守恒可以确定硫酸根、铁离子物质的量,根据电荷守恒有:n(OH-)+2n(SO42-)=3n(Fe3+),可以计算n(OH-),据此计算解答.
解答 解:硫酸厂烧渣焙烧时,FeS与氧气反应生成氧化铁与二氧化硫,再用硫酸酸浸,Fe的氧化物与硫酸反应得到盐,二氧化硅不反应,过滤得到滤渣为SiO2,滤液中加热过氧化氢,将溶液中Fe2+氧化为Fe3+,再结构系列转化得到碱式硫酸铁.
(1)二氧化硫与足量的氢氧化钠反应生成亚硫酸钠与水,反应离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
(2)滤渣为不与硫酸反应的二氧化硅,故答案为:SiO2;
(3)反应1中加双氧水的目的是:将溶液中Fe2+氧化为Fe3+,故答案为:将Fe2+氧化为Fe3+;
(4)步骤②中得到2.3300g固体为BaSO4沉淀,其物质的量为$\frac{2.33g}{233g/mol}$=0.01mol,根据硫酸根守恒,则n(SO42-)=n(BaSO4)=0.01mol,步骤③中得到0.6400g为氧化铁的质量,其物质的量为$\frac{0.64g}{160g/mol}$=0.004mol根据Fe元素守恒,则n(Fe3+)=2n(Fe2O3)=0.008mol,根据电荷守恒有:n(OH-)+2n(SO42-)=3n(Fe3+),故n(OH-)=3×0.008mol-2×0.01mol=0.004mol,故碱式硫酸铁样品中的n(OH-):n(SO42-)=0.004mol:0.01mol=2:5,
故答案为:2:5.
点评 本题考查物质制备方案、物质组成的测定等,(4)中注意利用守恒法计算,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 甲装置:用所示装置分离出溴苯 | |
| B. | 乙装置:加热浓硫酸和乙醇混合液,制取乙烯 | |
| C. | 丙装置:加热苯和硝基苯的混合物,分离出苯 | |
| D. | 丁装置:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.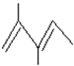 .
.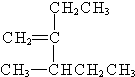 3-甲基-2-乙基-1-戊烯;
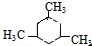
3-甲基-2-乙基-1-戊烯; 2,2,6-三甲基-4-乙基辛烷.
2,2,6-三甲基-4-乙基辛烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为0.25 mol•L-1 | |
| B. | Y为0.1 mol•L-1 | |
| C. | Z为0.2 mol•L-1 | |
| D. | Z为0.25 mol•L-1时,Y为0.45 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com