
| A. | 乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键 | |
| B. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 制造玻璃是复杂的物理变化,玻璃的组成不同,性能不同 |
分析 A.苯中不含碳碳双键;
B.甲醇汽油燃烧生成二氧化碳,不能减少碳的排放;
C.红外光谱仪可确定有机物中的官能团和化学键、核磁共振仪可确定有机物中H的种类、质谱仪可确定相对分子质量;
D.二氧化硅与碳酸钠、碳酸钙是制造玻璃的原料.
解答 解:A.苯中不含碳碳双键,但乙烯、植物油和苯都能与氢气发生加成反应,故A错误;
B.甲醇汽油燃烧生成二氧化碳,不能减少碳的排放,开发核能、太阳能等新能源,使用无磷洗涤剂都可直接降低碳排放,故B错误;
C.红外光谱仪可确定有机物中的官能团和化学键、核磁共振仪可确定有机物中H的种类、质谱仪可确定相对分子质量,则红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析,故C正确;
D.二氧化硅与碳酸钠、碳酸钙是制造玻璃的原料,二氧化硅与碳酸钠、碳酸钙能发生化学反应,玻璃的组成不同,性能不同,故D错误;
故选C.
点评 本题考查有机物的结构、性质及反应等,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol NH4+ 含有的电子总数为10NA | |
| B. | 1mol Mg 与足量盐酸反应时失去NA个电子 | |
| C. | 28g N2 所含原子数目为NA | |
| D. | 在101KPa、25℃条件下,11.2L H2 中含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
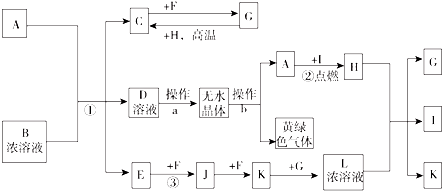
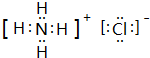 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
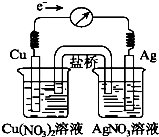 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | 当电流计指针指向0时,该反应达平衡,平衡常数K=0 | |
| C. | 若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 | |
| D. | 向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
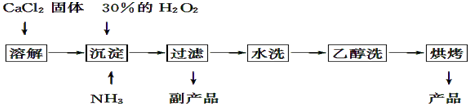
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO- | |
| B. | 常温下Kw/c(H+)=1×10-13mol/L的溶液中:SO42-、Fe2+、ClO-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol/LAlCl3溶液中可能大量存在:Ca2+、AlO2-、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
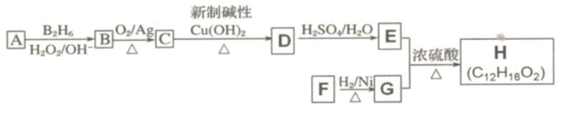
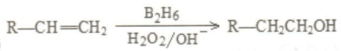
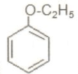 是同分异构体
是同分异构体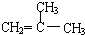 .
.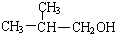 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2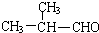 +2H2O.
+2H2O.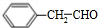 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.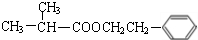 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$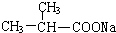 +
+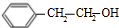 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com