
| A. | 无色无毒气体A为H2 | |
| B. | 最后气体为NH3 | |
| C. | 在镁与硝酸反应过程中还原剂与氧化剂的物质的量之比为5:1 | |
| D. | 气体A与气体B的体积比为1:1 |
分析 反应完全后向剩余溶液中加入过量NaOH固体并加热,放出气体B,应为氨气,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,说明气体具有还原性,将剩余气体用浓硫酸干燥,气体体积变为原来的三分之一,灼热氧化铜变红过程发生的反应有2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,说明含有氢气生成,则在原A、B混合气体中氨气占三分之二,气体A与气体B的体积之比为1:2,可写出反应的离子方程式,结合方程式解答该题.
解答 解:反应完全后向剩余溶液中加入过量NaOH固体并加热,放出气体B,应为氨气,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,因2NH3+3Cu$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,气体体积只减少一半,所以气体A能与氧化铜反应且气体体积减少的氢气,因为气体体积变为原来的三分之一,则在原A、B混合气体中氨气占三分之二,气体A与气体B的体积之比为1:2,由上可知镁与稀硝酸的反应的离子方程式为9Mg+22H++2NO3-=2NH4++H2↑+9Mg2++6H2O,最后生成气体是氢气,只有A正确,
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的性质以及生成气体的推断,把握体积的变化,最终能写出反应的离子放出为解答该题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化剂和还原剂的物质的量之比为5:6 | |
| B. | 产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成酸滴(雾) | |
| C. | 上述反应中消耗3molP时,转移电子的物质的量为15mol | |
| D. | 产物P2O5为酸性氧化物,但不是磷酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3常用作制冷剂 | B. | 烧碱:治疗胃酸过多的一种药剂 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH溶液}{→}$NaNO3 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3$\stackrel{NaOH溶液}{→}$NaSiO3 | |
| D. | NaSO4溶液$\stackrel{BaCl_{2}溶液}{→}$BaSO4$\stackrel{盐酸}{→}$BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水 | B. | 0.5mol/L的盐酸 | ||
| C. | 0.5mol/L的醋酸 | D. | 0.5mol/L的氯化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠显示了强还原性 | B. | 二氧化碳是酸性氧化物 | ||
| C. | 金属钠熔点较低 | D. | 二氧化碳也能起助燃作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
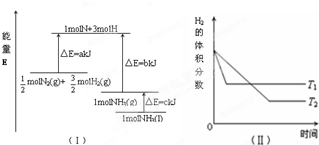
| A. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | 该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1 | |
| C. | T1>T2,且正反应为放热反应 | |
| D. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com