
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产![]() 的过程中完成乙烯氯化,下列叙述错误的是( )
的过程中完成乙烯氯化,下列叙述错误的是( )
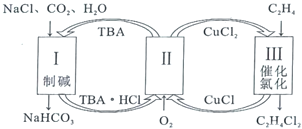
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、![]() 的再生
的再生
C.理论上每生成![]() ,可得到
,可得到![]()
D.过程Ⅲ中的反应是
【答案】C
【解析】
根据题意可知,制碱过程为NaCl+CO2+H2O+TBA=NaHCO3+TBA·HCl,过程Ⅱ为TBA的再生过程为2CuCl+![]() O2+2TBA·HCl=2CuCl2+2TBA+H2O,乙烯的氯化过程为
O2+2TBA·HCl=2CuCl2+2TBA+H2O,乙烯的氯化过程为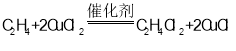 ,由此分析。
,由此分析。
A.侯德榜制碱法是先把氨气通入食盐水,然后向氨盐水中通二氧化碳,生产溶解度较小的碳酸氢钠。再将碳酸氢钠过滤出来,经焙烧得到纯净洁白的碳酸钠,由图可知,过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气,故A正确;
B.过程Ⅱ为TBA的再生过程为2CuCl+![]() O2+2TBA·HCl=2CuCl2+2TBA+H2O,实现了TBA、
O2+2TBA·HCl=2CuCl2+2TBA+H2O,实现了TBA、![]() 的再生,故B正确;
的再生,故B正确;
C.制碱过程为NaCl+CO2+H2O+TBA=NaHCO3+TBA·HCl,理论上每生成![]() ,需要1molTBA,根据关系式TBA~ CuCl~
,需要1molTBA,根据关系式TBA~ CuCl~![]() ,故C错误;
,故C错误;
D.过程Ⅲ是乙烯的氯化过程,化学方程式为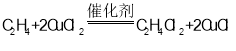 ,故D正确;
,故D正确;
答案选C。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1周围产生细小气泡,C2周围无明显现象;持续通电一段时间后,C2周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:2H2O+2e-= H2↑+2OH-
B.自制消毒剂的总反应为:NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
C.可以用两根铁钉代替铅笔芯完成实验
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
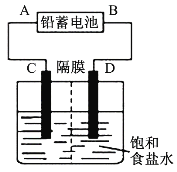
铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
(1)铅蓄电池放电时的正极反应为___。
(2)请写出电解饱和食盐水的化学方程式:____。
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为___极。
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子____mol。
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为___L。
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)___(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬太尼属于管制类药物,可用作镇痛麻醉药。其合成路线如下:

已知信息: ①RX+![]()
![]()
![]()
②RCH2COOR′+R″COOR′′′![]()
![]()
③![]() + CH2=CH2
+ CH2=CH2![]()
![]()
(1)下列说法正确的是______________。
A.化合物B到C的转变涉及到的两步反应依次是加成反应、取代反应
B.化合物C具有碱性,能与盐酸反应
C.化合物F可通过化合物A一步反应制备得到
D.芬太尼的分子式是C22H28N2O
(2)化合物X的结构简式是________________________。
(3)D→E的转化过程有多个中间产物,写出D在NaH/THF条件下发生反应的化学方程式______________________________。
(4)有机物Y(C4H7O2N)是有机物X的含氮衍生物,同时符合下列条件的Y的同分异构体的结构简式_________________________。
①分子中有一个六元环;
②1HNMR谱和IR谱检测表明分子中有3种化学环境不同的氢原子,没有过氧键(-O-O-)。
(5)设计以NH3和X为原料制备M(![]() )的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
)的合成路线(无机试剂任选,合成中须用到上述②③两条已知信息,用流程图表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
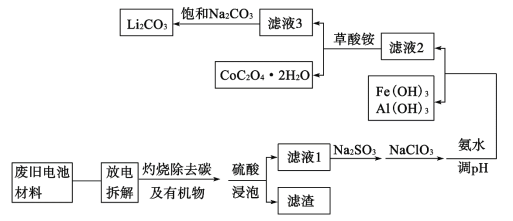
(1)“拆解”前需进入“放电”处理的目的是__;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__。
(3)滤液1中加入Na2SO3的主要目的是__;加入NaClO3的主要目的是__。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
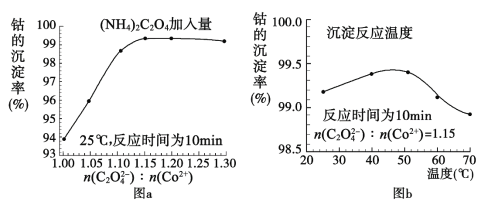
根据图沉钴时应控制n(C2O42-):n(Co2+)比为__,温度控制在__℃左右。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com