
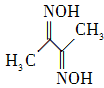
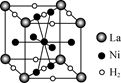


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


 ͼ2
ͼ2 �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���۵㣺Al>K>Na | B�����İ뾶��Cl��>Na��>Mg2+>A13+ |
| C�����ȶ��ԣ�HF>HCl>HBr>HI | D�����������������AlO2��>CO32��>F�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ������ | X | Y | Z |
| �۵�/K | 1266 | 1534 | 183 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
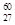 Co��r���ߵķ���Դ������
Co��r���ߵķ���Դ������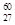 27Co��˵����ȷ����
27Co��˵����ȷ���� | A��������Ϊ 33 | B��������Ϊ27 | C��������Ϊ60 | D���˵����Ϊ60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��W��M��ij�ֵ��ʿ���Ϊˮ�����е������� |
| B�����YW2����������Ƶ�Y��W�ĵ��� |
| C����ͬ�����£�w���⻯��ˮ��Һ���Ա�Z�� |
| D��X��M����Ԫ���γɵ�һ�ֻ�������ˮ��Ӧ������M��ij�ֵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ڡ��� | B���٢ܡ��� | C���ڢۡ��� | D���ۢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com