
【题目】在一定条件下Na2CO3溶液存在水解平衡:CO32-+ H2O ![]() HCO3-+ OH-,下列说法正确的是( )
HCO3-+ OH-,下列说法正确的是( )
A.Na2CO3溶液:![]()
B.升高温度,溶液pH减小
C.稀释溶液,溶液中所有离子浓度都减小
D.加入Ba(OH)2固体![]() 增大
增大
科目:高中化学 来源: 题型:
【题目】位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是自然界中含量最高的金属。根据你的推断完成下列问题:
(1)E元素在周期表中的位置为_______。
(2)写出由上述元素形成的具有漂白作用的三种物质的化学式_______。
(3)用电子式表示C与D形成化合物的过程_______。
(4)写出E的最高价氧化物与强碱反应的离子方程式________。
(5)B、C两元素形成的原子个数比为1:1的化合物中的化学键为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
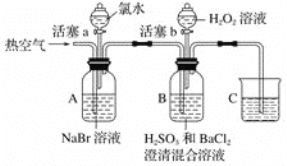
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是______。
(2)实验操作Ⅱ吹入热空气的目的是_____。
(3)装置C的作用是_____,C中盛放的药品是_____。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是_____。
(5)由上述实验得出的结论是______。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如图所示,下列说法正确的是
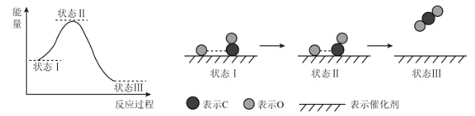
A.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
B.同物质的量的CO和O反应比CO与O2反应放出更多的热量
C.CO和O生成CO2是吸热反应
D.在该过程中,CO断键形成C和O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子机器设计和合成”有着巨大的研究潜力。人类步入分子器件时代后,使得光控、温控和电控分子的能力更强。如图是蒽醌套索醚电控开关。下列说法错误的是

A. 物质Ⅰ的分子式是C25H28O8 B. 反应[a]是氧化反应
C. 1molⅠ可与8molH2发生加成反应 D. 物质Ⅰ的的所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lgc(OH-)]。下列说法正确的是

A.曲线N表示![]() 与pOH的变化关系
与pOH的变化关系
B.常温下,Ka2(H2XO3)=10-10
C.当pOH=2时, NaHXO3溶液中:![]()
D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO3-)+2c(XO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类中,所属关系不符合“X包含Y、Y包含Z”的有
选项 | X | Y | Z |
A | 芳香族化合物 | 芳香烃的衍生物 |
|
B | 脂肪族化合物 | 链状烃的衍生物 | CH3COOH(乙酸) |
C | 环状化合物 | 芳香族化合物 | 苯的同系物 |
D | 不饱和烃 | 芳香烃 |
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+![]() Fe3+的转化时,①中的Fe2+作______________剂,②中的Fe3+作__________剂;
Fe3+的转化时,①中的Fe2+作______________剂,②中的Fe3+作__________剂;
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作__________剂,具有____________性;设计实验证明维生素C的性质,要求写出实验所用的试剂:____________; 维生素可根据其溶解性的不同分为____________性维生素和____________性维生素两大类,维生素C属于____________性维生素。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com