
在容积均为500 mL的I、Ⅱ、Ⅲ三个密闭容器中分别充入l molN2和2.5 molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2(g)+3H2(g)2NH3(g) H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是
H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是
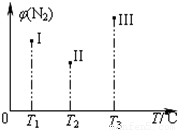
A.当z,v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态
B.在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ
C.在t min时,一定没有达化学平衡状态的是I
D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小
C
【解析】A、若为一个表示正反应速率、另一个表示逆反应速率,反应到达平衡,若为同方向速率,选项A中关系式在任何情况下都成立,不能说明到达平衡,没有指明H2和N2的正逆反应速率,不能说明反应达到了平衡状态,故A错误;B、由于不能确定容器II中氮气是否达到最小值,因此不能确定II是否达到平衡状态,故B错误;C、若未达平衡,温度越高反应速率越快,相同时间内氮气的含量越低,tmin时,氮气的含量Ⅲ比Ⅱ高,故Ⅲ到达平衡,故C正确;D、由质量守恒定律知,总质量不变,该反应为体积缩小的反应,Ⅲ中N2的含量最大,故总物质的量最大,故Ⅲ平均相对分子质量最小,故D错误;故选C.
考点:物质的量或浓度随时间的变化曲线;体积百分含量随温度、压强变化曲线


科目:高中化学 来源: 题型:
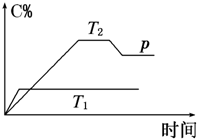
 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省石家庄市毕业班第二次模拟考试理综化学试卷(解析版) 题型:计算题
)含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为__________________
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3 min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正 、 V逆)

(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。
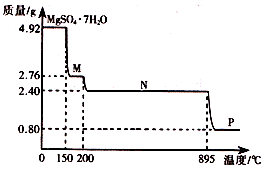
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省临沂市临沭实验中学高二(上)期中化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com