
分析 根据n=cV,N=nNA计算;根据n=$\frac{m}{M}$,c=$\frac{n}{V}$计算;溶液为均一稳定分散系,取出任意体积都和原溶液浓度相等;根据溶液稀释前后溶质的物质的量不变计算稀释后溶质的物质的量浓度.
解答 解:n=$\frac{m}{M}$=$\frac{20g}{40g/mol}$=0.5mol,c=$\frac{0.5mol}{0.25L}$=2mol/L;从中取出1mL,其物质的量浓度不变,为2mol/L;n=cV=0.001L×2mol/L=0.002mol,m=nM=0.002mol×40g/mol=0.08g;溶液稀释前后溶质的物质的量不变,这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为$\frac{0.001L×2mol/L}{0.1L}$=0.02mol/L;其中含Na+的物质的量为:0.02mol/L×0.1L=0.002mol,质量为0.002mol×23g/mol=0.046g,
故答案为:2mol/L;2mol/L;0.08g;0.02mol/L;0.046g.
点评 本题考查物质的量浓度计算,题目难度不大,注意有关计算公式的运用,把握溶液的特点以及溶液稀释前后溶质的物质的量不变的特征


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
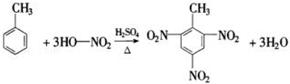 .
.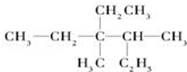 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷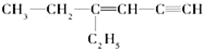 ,其中在同一平面上的碳原子至少为6个.
,其中在同一平面上的碳原子至少为6个.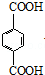 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
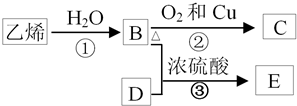
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 爆炸一定都属于化学变化 | |
| B. |  盛放氰化钠的容器上应贴有如图所示的安全标识 | |
| C. | 生石灰烧伤应立即用大量的水冲洗并涂上中和剂硼酸 | |
| D. | TNT爆炸的产物只有CO、CO2及氮氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
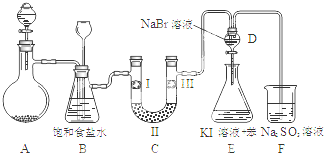
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,4.0 g CH4中含有共价键的数目为NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com