分析:(1)根据m=nM=cVM计算需要氢氧化钠的质量;
(2)根据操作步骤选取实验仪器;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=
分析操作对所配溶液浓度的影响;
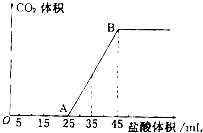
(4)由图可知,从25mL开始生成二氧化碳,反应为HCO
3-+H
+=CO
2↑+H
2O,当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠,
①从25mL开始生成二氧化碳,反应为HCO
3-+H
+=CO
2↑+H
2O,生成二氧化碳消耗的盐酸为35mL-25mL=10mL,根据方程式可知n(CO
2)=n(HCl),
根据n=cV计算n(HCl);
②当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠,根据钠元素守恒有n(NaOH)=n(NaCl),根据氯元素守恒有n(NaCl)=n(HCl),计算出n(NaOH),再根据V=
计算氢氧化钠溶液的体积.
解答:
解:(1)配制500mL0.1mol/L NaOH溶液需要氢氧化钠的质量为0.1mol/L×0.5L×40g/mol=2.0g,故答案为:2.0;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,将洗涤液移入容量瓶,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,筒量(可用可不用);
还需要的玻璃仪器仪器是:500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(3)a.加水时越过刻度线,所配溶液的体积偏大,所配溶液的浓度偏低,故a符合;
b.烧杯和玻璃棒上沾有少量的氢氧化钠,未洗涤烧杯和玻璃棒,移入容量瓶内氢氧化钠的物质的量减小,所配溶液的浓度偏低,故b符合;
c.溶液配制需加水定容,容量瓶内壁附有水珠而未干燥处理对所配溶液的浓度无影响,故c不符合;
d.定容时俯视刻度线,导致所配溶液的体积偏小,所配溶液的浓度偏高,故d不符合.
故选:ab;
(4)由图可知,从25mL开始生成二氧化碳,反应为HCO
3-+H
+=CO
2↑+H
2O,当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠.
①从25mL开始生成二氧化碳,反应为HCO
3-+H
+=CO
2↑+H
2O,生成二氧化碳消耗的盐酸为35mL-25mL=10mL,根据方程式可知
n(CO
2)=n(HCl)=0.01L×1mol?L
-1=0.01mol,
故答案为:0.01;
②当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠,根据钠元素守恒有n(NaOH)=n(NaCl),根据氯元素守恒有n(NaCl)=n(HCl)=0.045L×1mol?L
-1=0.045mol,所以n(NaOH)=n(NaCl)=0.045mol,氢氧化钠溶液的体积为
=0.45L=450mL,
故答案为:450.

 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题

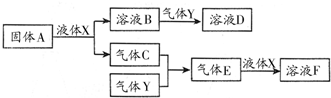
 甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验: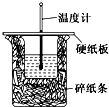 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: