


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
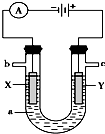 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X只能是第三周期元素 |
| B、a-b+n+m=10或16 |
| C、b不大于6 |
| D、Y不可能是第二周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
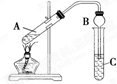 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.| 组 序 号 | 催化剂 | 反应现象 | C中饱和碳 酸钠溶液中 酯层高度 |
| ① | 2mL 98% 浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 | 2.10cm |
| ② | 2mL 14mol?L-1 硫酸 | 反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.14cm |
| ③ | 2mL 10mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.16cm |
| ④ | 2mL 7mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 | 2.00cm |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.44g | B、1.6g |
| C、2.82g | D、4.36g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁>丙>乙>甲 |
| B、丁>甲>乙>丙 |
| C、甲=丁>乙=丙 |
| D、丁<丙<乙<甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9g | B、10g |
| C、8.5g | D、8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com