

| A. | 步骤①和②中的气体属于可循环使用的气体 | |
| B. | 步骤②中发生的反应为:Ca2++CO2+2NH3•H2O═CaCO3↓+2NH4++H2O | |
| C. | 往甲中通CO2有利于(NH4)2SO4生成 | |
| D. | 以上涉及的化学反应中有氧化还原反应 |
分析 某化肥厂用H2O、CO2、NH3、CaSO4、制备(NH4)2SO4,由于氨气的溶解 度远远大于二氧化碳,所以根据题中工艺流程可知,硫酸钙悬浊液中先通入氨气得甲混合液,再通入二氧化碳得硫酸铵和碳酸钙的混合物质C,过滤得硫酸铵溶液和碳酸钙固体,碳酸钙在高温下分解生成二氧化碳和氧化钙,二氧化碳可以循环利用,硫酸铵溶液经过提纯可得硫酸铵固体,据此答题.
解答 解:某化肥厂用H2O、CO2、NH3、CaSO4、制备(NH4)2SO4,由于氨气的溶解 度远远大于二氧化碳,所以根据题中工艺流程可知,硫酸钙悬浊液中先通入氨气得甲混合液,再通入二氧化碳得硫酸铵和碳酸钙的混合物质C,过滤得硫酸铵溶液和碳酸钙固体,碳酸钙在高温下分解生成二氧化碳和氧化钙,二氧化碳可以循环利用,硫酸铵溶液经过提纯可得硫酸铵固体,
A、根据上面的分析可知,氨气不可以循环使用,二氧化碳可以循环使用,故A错误;
B、实验中用的是硫酸钙悬浊液,在离子方程式中应用化学式表示,所以步骤②中发生的反应为:CaSO4+CO2+2NH3•H2O═CaCO3↓+2NH4++H2O+SO42-,故B错误;
C、往甲中通CO2会生成碳酸钙沉淀,所以利于(NH4)2SO4生成,故C正确;
D、根据上面的分析可知,整个流程中不涉及氧化还原反应,故D错误,
故选C.
点评 本题考查了流程分析判断,物质性质的分析应用,熟记常用的化学方程式,掌握了解物质的相互转化和制备的方法及注意事项,题目难度中等.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | -14.2 KJ/mol | B. | -28.4 KJ/mol | C. | -42.6 KJ/mol | D. | -56.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | |
| 1.向打磨过的铝片中加入稀盐酸 | |
| 2.向打磨过的铝片中加入Na0H溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: )你认为该装置中可以加入苯或CCl4液体.
)你认为该装置中可以加入苯或CCl4液体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
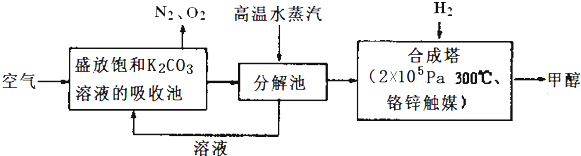
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

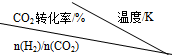 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③⑤ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com