
【题目】下列有关化学电池的说法中正确的是
A.化学电池只能将化学能转化为电能
B.燃料电池能将全部化学能转化为电能
C.锌银电池比能量大,电压稳定,储存时间长
D.一次电池包括干电池和蓄电池
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】若某基态原子的外围电子排布为3d14s2,则下列说法正确的是( )
A. 该元素属于P区B. 该元素原子核外有4个电子层
C. 该元素原子最外层共有3个电子D. 该元素原子M能层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是________。
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
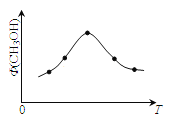
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系如图,则上述CO2转化为甲醇的反应的△H_____0(填“>”、“<”、“=”)
(3)上述反应在实际生产中采用的温度是300℃,其目的是_________________。
(4)300℃时,将CO2与H2按1∶3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图所示。回答问题:
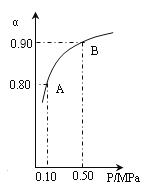
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1∶3 D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为_______________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为______。
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有_____________个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为___________________。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是____________,1 mol该配合物中含有的![]() 键数目是____________。
键数目是____________。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种 离子晶体的晶格能数据如下:

KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为______________________。
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_____个:Ti原子的配位数为______;此配位原子构成的空间构型为_____;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为______g·cm-3、NA为阿伏加德罗常数的值,只列计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图,下列说法正确的是( )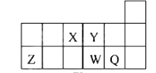
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W) >r(Q)
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系下表:
温度℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有如下两个反应:①NaOH + HCl =" NaCl" + H2O;②Fe +H2SO4= FeSO4 + H2 ↑
两反应中为放热反应的是 ,能设计成原电池的是 。(填序号)
(2)根据下图填空①电子从 片流出,溶液中H+向 片移动。

② 正极的现象是 ,发生 反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr2O72-和CN-是工业废水中常见的污染物。若利用下列流程可对分别含两种离子的废水进行综合处理:

回答下列问题:
(1)已知步骤②中无气体生成,写出反应的离子方程式_______________,步骤④中NaClO可将CNO-处理为完全无害的溶液,该过程中有两种无毒的不支持燃烧的气体产生,写出这两种气体的化学式___________________。
(2)步骤⑥的反应为 S2O32-+ Cr2O72-+2H+→SO42-+ Cr3++H2O(未配平),则每处理1mol Cr2O72-离子转移_______mol电子。
(3)步骤⑦的操作名称为_______,该操作所需的玻璃仪器为____________。
(4)CrO42-和Cr2O72-在溶液中可相互转化,用离子方程式表示K2Cr2O7溶液中的转化反应_____。
(5)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全(铬离子浓度应小于10-5mol/L)。已知Cr(OH)3的溶度积为6.3×10-31, ![]() ≈4,lg2≈0.3。
≈4,lg2≈0.3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol/LNa2SO4溶液中,Na+的物质的量浓度是
A. 0.1 mol/LB. 0.2 mol/LC. 0.05mol/LD. 1 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com